在做慢病毒包装实验中,大家是不是经常遇到:用同样的病毒载体系统进行实验,为什么有人做的很好,次次成功,有人却是时常做不出来,稳定性很差,不是滴度低就是根本不出毒?

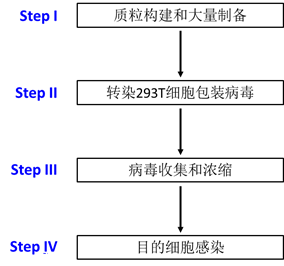
今天汉恒就把10年的病毒包装经验总结给大家,首先我们来简要介绍下慢病毒包装的流程:
影响慢病毒包装是否成功的因素有很多,例如:细胞状态、质粒比例、质粒抽提纯化情况、转染试剂和条件、目的基因本身的影响等等。我们详细列出了如下几点。
我们进行慢病毒包装时要重视实验材料——建议使用商品化的成熟毒载体系统,汉恒生物慢病毒包装三质粒系统为:psPAX2, pMD2.G 及 pHBLVTM系列质粒。包装细胞293T细胞培养时要让它“白白胖胖、活力充沛”。并且要定期纯化包装细胞、检测表达质粒。
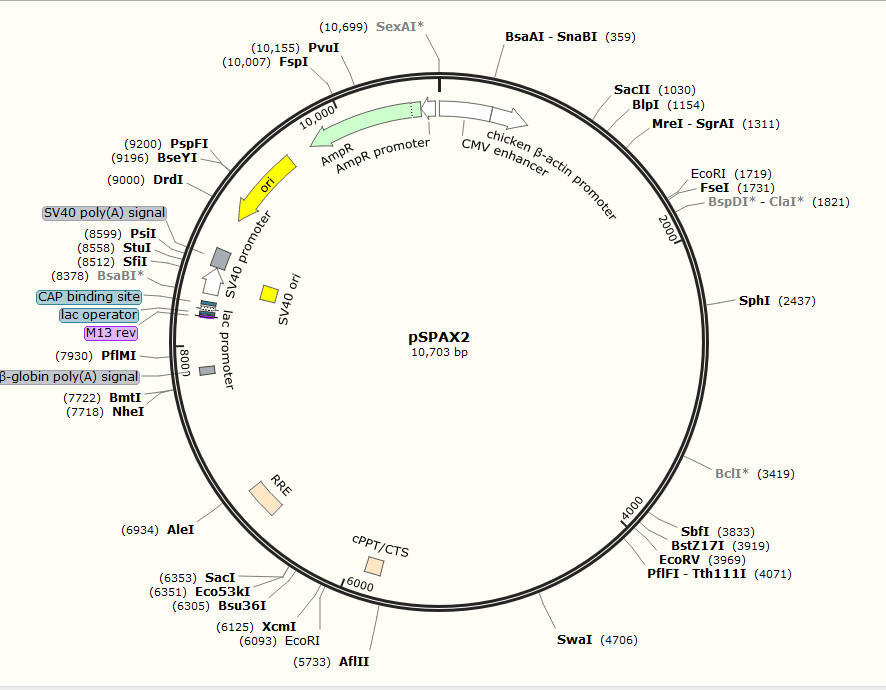
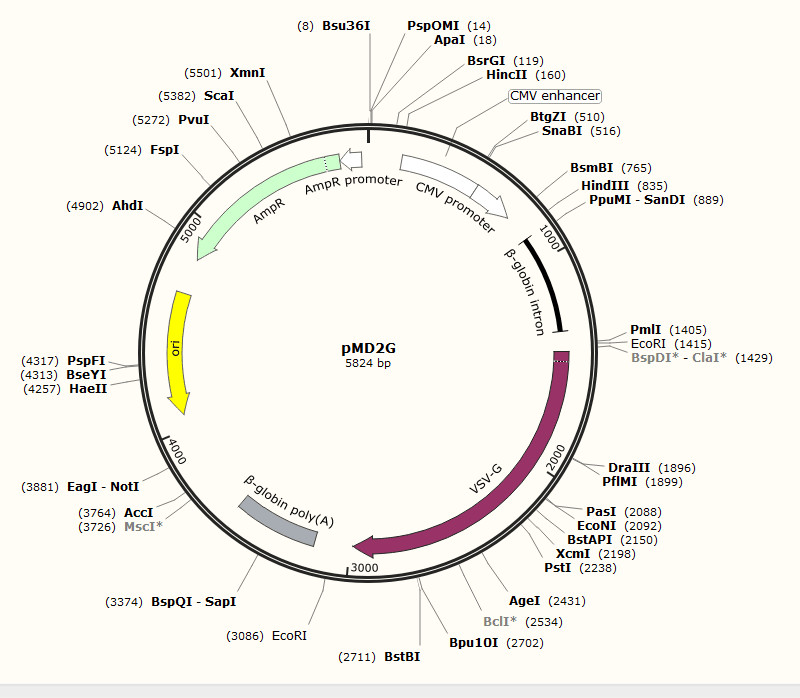
慢病毒包装辅助质粒图谱(点开查看大图)
2、目的基因对慢病毒包装的影响
目的基因的大小、序列情况、目的蛋白的功能毒性等都有可能导致包装失败。一般慢病毒包装的目的片段大小在2.5k以内较为合适,大于2.5k会降低滴度或超过载体容量无法包装。并且,可能存在一些基因表达翻译后对包装细胞产生毒性,导致细胞状态异常,无法完成病毒包装,这种情况我们可以尝试更换病毒包装系统,例如选择包装腺病毒。
3、载体构建和抽提纯化环节
载体构建时我们需要注意是否存在以下情况:质粒载体重组、某个部件缺失、污染别的质粒或杂物、中抽纯化污染等。要养成同时做阴性对照的习惯:目的基因载体和阴性对照GFP 载体是同一批,且每次包装都如此操作。要保证目的基因的表达载体构建纯化良好,质粒间比例得当,建议三质粒包装系统质粒转染时的摩尔比为1:1:1。
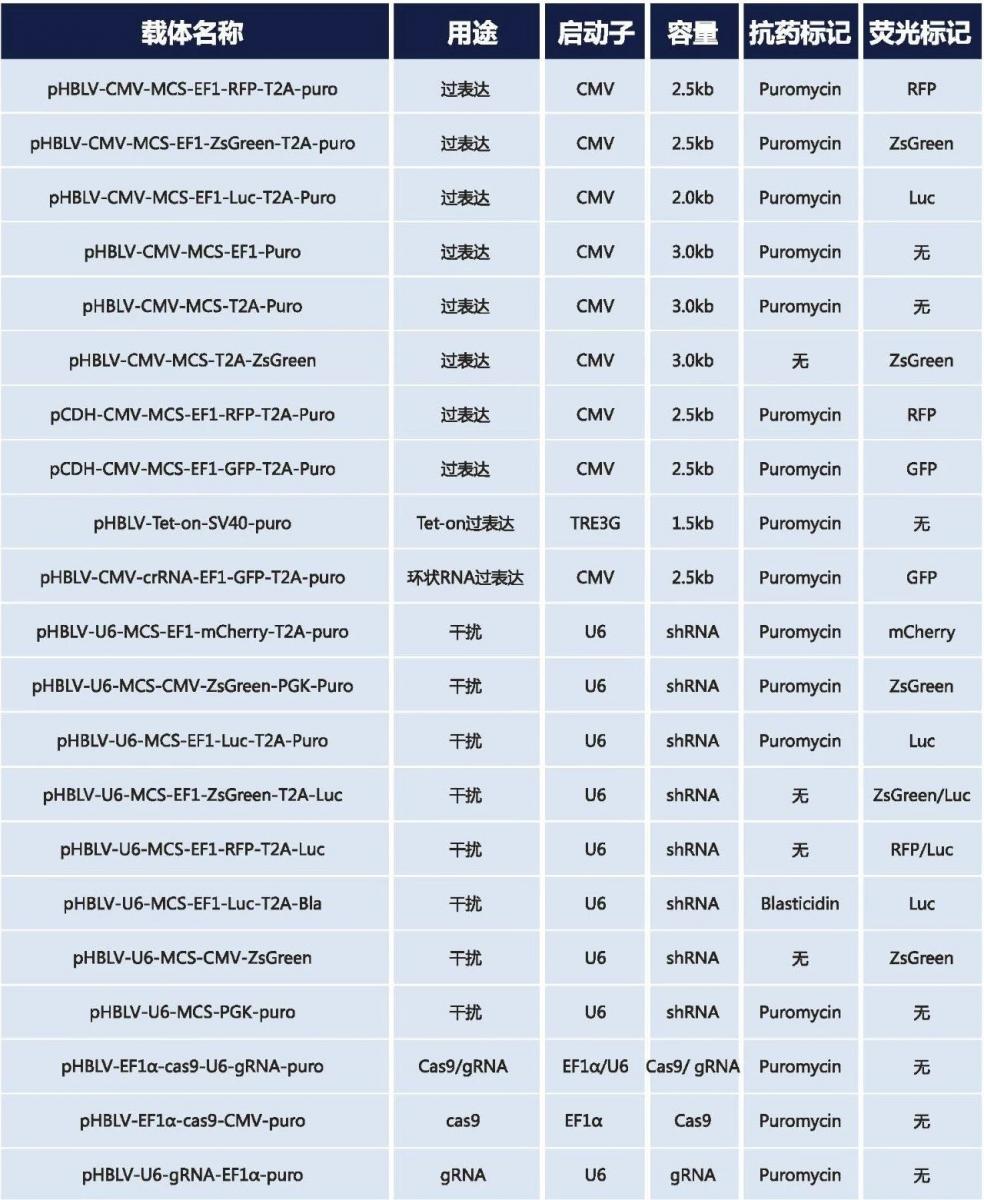
汉恒pHBLV系列质粒list
4、细胞转染及病毒收集阶段
细胞出毒期间过程中的细胞活力是包装成功及病毒滴度高低的一个重要环节,进行包装转染293T细胞前一定要重视细胞是否干净、饱满立体感是否好、铺板是否均匀,细胞密度在50-60%时进行包装比较合适。在24、48 小时的要观察细胞及荧光状态,判断是否正常,转染后48h和72h分别两次收集病毒上清(48h收集后置换新鲜培液)。
当然,最重要的是,在进行慢病毒质粒转染293T细胞时,使用汉恒生物慢病毒包装专用转染试剂:LentiFitTM。效率高、毒性低,血清的存在不影响转染效率,让你的细胞在包装慢病毒时“又圆又胖”,大大提高了慢病毒包装的成功率。
购买正装还有礼品拿哦

如果您觉得慢病毒包装过于繁琐,想要快速高效地完成实验,可以直接联系我们包装病毒哦~
- 浏览 7237 次








