病毒一直是基因转导研究中的一大利器,尤其 慢病毒 更是实验室的常客。然而,慢病毒的存储不当或用量不合适,可能会导致转染效率低,细胞状态差等情况。为了让慢病毒更好地为我们的实验服务,先来看看慢病毒使用过程中我们要注意哪些问题吧。
首先是慢病毒的安全和存储
慢病毒相关实验需要在生物安全柜(BL-2级别)内进行操作,如果不小心溅出也不要惊慌,立即用70%乙醇加 1%的SDS溶液擦拭干净即可。接触过病毒的枪头,离心管,培养板等要用84消毒液浸泡后统一处理。病毒相关的废弃物也需要特殊收集再统一经高温灭菌处理哦。
慢病毒是存储在-80℃的,如果您在收到慢病毒的一周内就会使用,也可放在4°C保存,避免反复冻融,有必要可以先进行分装。
接下来就是慢病毒的使用了,首先需要摸索病毒感染的MOI
MOI(Multiplicity of Infection,感染复数)是指每个细胞感染的病毒数,通常MOI越高,病毒整合到染色体的数量以及目的蛋白的表达量越高。
用96孔板摸索梯度值:
实验前一天,以每毫升3~5X10^6个目的细胞接种96孔培养板中的12个孔,
体积为90 µl。感染预实验共分为四组,每组三个不同梯度的MOI。
实验开始,配备1X10^8TU/ml、1X10^7TU/ml、1X10^6TU/ml病毒液。
将10 µl三个不同梯度的病毒加到各组的相应孔中。加入的病毒量分别为1X10^6TU,1X10^5 TU,1X10^4 TU,而细胞经过生长,此时细胞的数目大约为1 X10^4个,所以三个孔的MOI分别为100、10、1
感染3-4天后,观察荧光表达情况,通过细胞感染效果,确认目的细胞的感染条件和感染参数。
※ 每孔加病毒量(µl)=MOI*细胞数/滴度(TU/ml)×1000
确定了细胞的MOI值,下面就要开始进行细胞的感染
我们推荐1/2小体积感染法,即在正常培养液的一半量的情况下加入慢病毒,感染4h后补足培养液至正常体积,感染24h后换液。对于适用Polybrene的细胞,也可适量加入来提升感染效率,它最常用的工作浓度为6~8µg/ml。
感染后48h,对于带GFP报告基因的病毒,可通过荧光显微镜观测GFP表达效率,如果要筛选稳定携带Puromycin抗性基因的病毒,则需换上含适当浓度Puromycin的新鲜完全培养液。
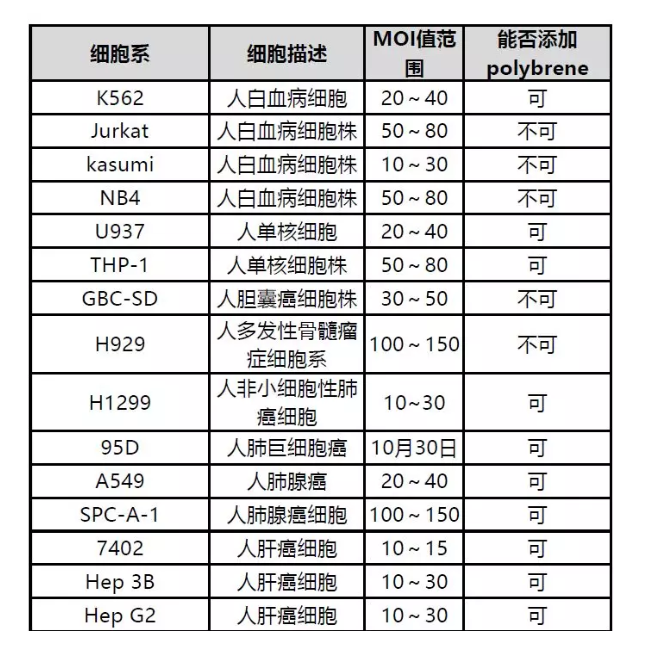
附:部分细胞慢病毒感染参数
注:不同实验室由于细胞的来源、代数和细胞状态等因素的影响,MOI值也略有差异,以下数据是在细胞感染效率在85-100%细胞状态良好的情况下获得的,仅供参考。
对于一些特殊的细胞在感染时我们还要注意以下事项
◆悬浮细胞:感染悬浮或半悬浮细胞,要通过平角离心转染法,低速(200´g)离心1 h,然后放入培养箱中正常培养即可。若由于实验条件有限,没有平角离心机,可用离心管代替。
◆极难感染的细胞:对于极难感染的细胞,如DC(树突状细胞)等,可采用多次感染的方法,即感染24 h后,更换新鲜病毒进行二次感染,可显著提升感染效率。
◆传代能力较差的原代细胞:对于一些传代能力较差的原代细胞,比如BMSC等,建议采用滴度更高的腺病毒进行感染。
A&Q| 以下是我们整理的在细胞感染中可能遇到的其他问题
1 对照病毒或目的病毒感染细胞以后,细胞形态发生改变或者细胞死亡,是否说明病毒有毒性?
首先,确定病毒是否有支原体或细菌污染;
其次,确定病毒感染MOI是否过高,梯度稀释后感染,寻找合适的MOI。
同时考虑目的细胞可能比较敏感,更换其它细胞感染确定病毒是否有问题。病毒对某些敏感细胞有毒性可能是不可避免的。
如果以上都排除后细胞状态仍然不好,尝试增加血清含量,观察细胞状态是否好转。
2 病毒感染目的细胞效率低?
和以下几个因素有关
◆病毒活性 解冻病毒一定要在冰上进行,尽量避免反复冻融, -80℃保存半年以上需要重新测滴度;
◆目的细胞 最好预实验测试过,看病毒载体是否合适感染目的细胞。一些难感染的细胞,如贴壁不好的细胞,原代细胞等,或者体内动物实验适合用腺病毒或AAV;
◆当然也和MOI值、感染时间以及是否加入polybrene等因素有关,可在实验中进行实当的摸索和调整,提升慢病毒的感染效率
3 为什么过表达慢病毒比对照的荧光要暗?
每种病毒有自己的载体容量,基因的插入,会影响位于其下游的荧光蛋白等基因的表达。对照病毒或干扰病毒,由于没有插基因或者插入基因非常短,荧光会强。而插入了较长基因之后,荧光的亮度会随着插入基因的长度以及特殊结构的存在等而减弱。
- 浏览 2118 次








