circRNAs(Circular RNAs,环状RNA分子)是一类不具有5'末端帽子和3'末端poly(A)尾巴、并以共价键形成环形结构的非编码RNA分子。circRNA是区别于传统线性RNA的一类新型RNA,具有闭合环状结构,大量存在于真核转录组中。
大部分的环状RNA 是由外显子序列构成,在不同的物种中具有保守性,同时存在组织及不同发育阶段的表达特异性。由于环状RNA对核酸酶不敏感,所以比线性RNA更为稳定,这使得环状RNA在作为新型临床诊断标记物的开发应用上具有明显优势。

汉恒circRNA环化系统,表达倍数高,100%成环
我们已知的circRNA功能有如下三种:
1)调节miRNA活性-ceRNA作用模式;
2)调节选择性剪接(alternative splicing)-与pre-mRNA竞争剪接;
3)调节RNA结合蛋白(RBPs)的存储,分类和定位-与蛋白直接结合;
上述三种circRNA机制作用方式,2)和3)由于需要用到RIP或RNA pull-down,实验执行难度大风险高,而1)调节miRNA活性-ceRNA作用模式的可行性及阳性率较高,是目前研究最热门的circRNA作用方式。
目前对于circRNA的研究还只是冰山一角,circRNAs的生物学功能也有待挖掘,因此是非常值得深入的研究方向。我们先来看看常规的circRNA研究思路(图1)
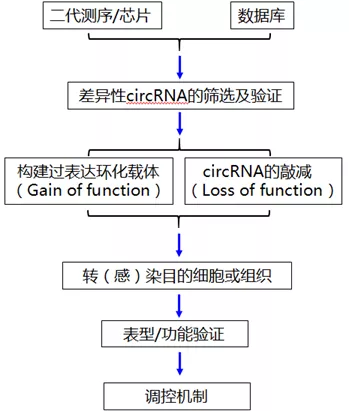
图1 circRNA常规研究思路
汉恒生物为了更好的帮助各位开展circRNA 的研究课题,我们的研究团队提出了基于ceRNA调控机制的circRNA系统研究方案。大致流程如下:
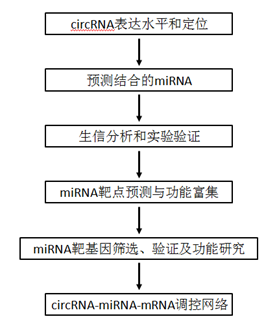
图2汉恒生物circRNA研究流程示意图
我们以hsa_circ_000244为例,来详细解读下cirRNA的系统研究方案。研究方向:前列腺癌。
1、验证circRNA的表达水平
以前列腺癌组织和癌旁组织的cDNA为样本,qPCR验证hsa_circ_000244的表达量及是否成环。
汉恒生物拥有的circRNA-qPCR验证技术,可设计特殊的circRNA验证引物,既可验证circRNA表达水平,同时又能区分成环与未成环RNA。
2、预测hsa_circ_000244可能结合的miRNAs
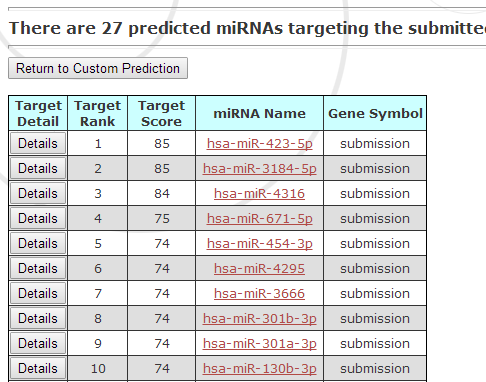
3、miRNAs信息学筛选及荧光素酶筛选验证
将hsa_circ_000244序列克隆构建至报告基因载体psiCHECK,合成上述预测到的miRNAmimics及对照,在293T细胞内同时转染miRNAmimics和psiCHECK-hsa_circ_000244,多功能酶标仪检测报告基因的表达水平,并筛选报告基因表达下调的miRNAs(可能有多个,本例中假定选择hsa-miR-301a-3p进行后续研究)
4、miRNA靶基因预测与功能富集分析
对hsa-miR-301a-3p进行靶基因预测,结果如下:
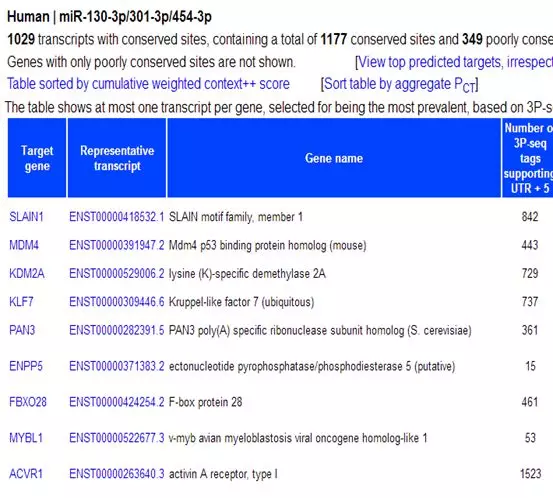
通过功能富集分析将前列腺癌相关的基因筛选出来:

5、miRNA靶基因筛选、验证及相关功能研究
(1)初筛:qPCR验证上述靶基因在前列腺癌组织和癌旁组织中的表达量差异,筛选与hsa_circ_000244表达呈正相关的靶基因(本例中hsa_circ_000244在癌组织中表达较低,因此需要筛选在癌组织中表达量较低的靶基因);
(2)进一步筛选:在前列腺癌细胞系中过表达hsa_circ_000244(使用汉恒生物的超强成环系统HBcirc-EnhancedTM circRNA慢病毒或腺病毒工具),qPCR验证上述靶基因表达水平。
汉恒生物HBcirc-EnhancedTM circRNA环化载体系统(图谱如下),上下游的成环元件经过精心设计、优化和验证,可以达到100%成环、表达倍数高的效果并可获得全长过表达circRNA的腺病毒,慢病毒或腺相关病毒,适用于各种细胞和动物模型。
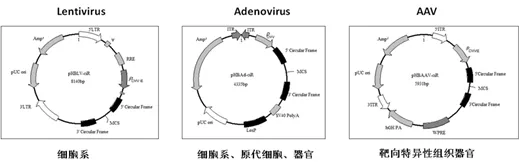
选择hsa_circ_000244过表达后,表达量也明显上调的靶基因作为研究对象,本例中假定为PTEN基因。查询PTEN的功能,发现它主要与细胞侵袭和迁移相关。
(3)在前列腺癌细胞系中封闭hsa-miR-301a-3p(使用汉恒生物的慢病毒或腺病毒工具),WB和qPCR检测PTEN的表达水平;
(4)在前列腺癌细胞系中封闭hsa-miR-301a-3p(使用汉恒生物的慢病毒或腺病毒工具),通过细胞迁移和细胞侵袭等实验,确定hsa-miR-301a-3p对细胞功能的影响;
(5)双荧光素酶报告基因实验:构建PTEN 3’UTR报告基因载体,将hsa-miR-301a-3p mimics与报告基因载体共转293T工具细胞,多功能酶标仪检测报告基因的表达水平,阐明hsa-miR-301a-3p作用于PTEN的分子机制;
注:为了实验的严谨性,可加入PTEN3’UTR区hsa-miR-301a-3p预测结合区域的突变体作为对照,进一步说明问题。
(6)前列腺癌细胞系中过表达hsa_circ_000244,检测hsa-miR-301a-3p和PTEN的表达水平及细胞功能学研究:
在前列腺癌细胞系中过表达hsa_circ_000244(使用汉恒生物的成环系统HB circ-EnhancedTMcircRNA慢病毒或腺病毒工具),然后分别进行如下实验:
1)WB和qPCR检测PTEN表达水平;
2)qPCR检测hsa-miR-301a-3p表达水平;
3)细胞迁移和细胞侵袭等实验,研究hsa_circ_000244对细胞功能的影响;
6、circRNA-miRNA-mRNA调控网络的验证
汉恒生物-circRNA-miRNA-mRNA调控机制研究解决方案:基于ceRNA作用方式和双荧光素酶报告基因实验,证明circRNA可rescue下游miRNA对其靶基因的抑制作用。
本实例的具体流程如下:
使用步骤5(5)中构建的PTEN3’UTR报告基因载体和步骤5(2)中构建的hsa_circ_000244过表达载体,将两者共转至293T工具细胞中,多功能酶标仪检测报告基因的表达水平,可间接证明hsa_circ_000244通过海绵吸附hsa-miR-301a-3p,从而上调PTEN靶基因的表达。
注:为了实验的严谨性,可加入PTEN 3’UTR区hsa-miR-301a-3p预测结合区域的突变体作为对照,进一步说明问题。
参考文献
1、Circular RNAs:diversity of form and function. Lasda E, Parker R. RNA. 2014 Dec;20(12):1829-42.
2、Circular RNAs are alarge class of animal RNAs with regulatory potency. Memczak S, Jens M,Elefsinioti A, Torti F, Krueger J, Rybak A, Maier L, Mackowiak SD, GregersenLH, Munschauer M, Loewer A, Ziebold U, Landthaler M, Kocks C, le Noble F, RajewskyN. Nature. 2013 Mar21;495(7441):333-8.
3、Circular RNA profilingreveals an abundant circHIPK3 that regulates cell growth by sponging multiplemiRNAs. Zheng Q, Bao C, Guo W, Li S, Chen J, Chen B, Luo Y, Lyu D, Li Y, Shi G,Liang L, Gu J, He X, Huang S.NatCommun. 2016Apr 6;7:11215.
4、Circular RNA Related tothe Chondrocyte ECM Regulates MMP13 Expression by Functioning as a MiR-136'Sponge' in Human Cartilage Degradation. Liu Q, Zhang X, Hu X, Dai L, Fu X,Zhang J, Ao Y. Sci Rep. 2016 Mar2;6:22572. D
- 浏览 4548 次








