一、腺相关病毒(Adeno-Associated Viral Vector,AAV)简介
腺相关病毒属微小病毒科( parvovirus),为无包膜的单链线状 DNA 病毒。AAV 的基因组约 4700bp,包括上下游两个开放读码框架(ORF),位于分别由 145 个核苷 酸组成的2 个反向末端重复序列(ITR)之间。基因组中有 3 个启动子(P5、P19 和 P40) 和 2 个开放阅读读框(ORF),rep 和 cap,如图 1 所示。rep 编码 4 个重叠的多功能蛋白,即 Rep78、Rep68、Rep52 和 Rep40,其中 Rep78 与 Rep68 参与 AAV 的复制与整合,Rep52 和 Rep40 具有解螺旋 酶和 ATP 酶活性,与 Rep78、Rep68 共同参与单链基因组的复制;cap 编码的 VP1、 VP2、VP3是装配成完整病毒所需要的衣壳蛋白,它们在 AAV病毒整合、复制和装配中其重要作用。
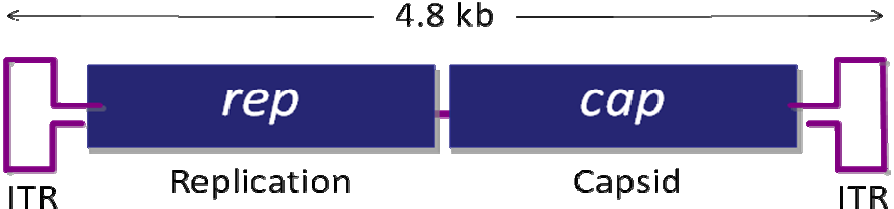
图1. AAV 基因组结构
二、腺相关病毒的优点
1. 安全性高:迄今从未发现野生型AAV 对人体致病,重组AAV 基因组序列上去 除了大部分的野生型AAV 基因组元件,进一步保证了安全性;
三、重组腺相关病毒载体系统简介
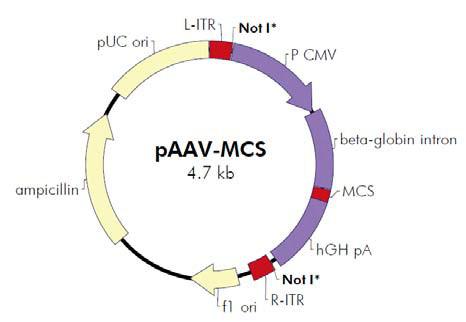
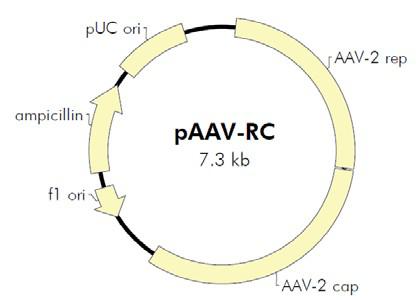
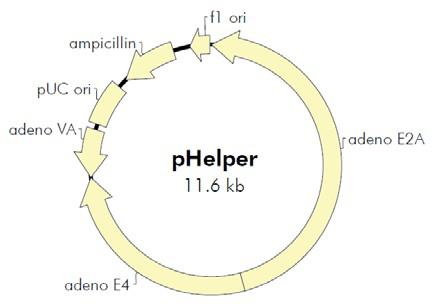
图2. AAV Helper-Free System腺相关病毒系统
三、重组腺相关病毒载体不同血清型
研究发现 AAV 具有多种血清型,各种不同血清型的 AAV 载体的主要区别是 衣壳蛋白不同,因此对不同的组织和细胞的转染效率存在差异。目前汉恒生物 在包装腺相关病毒时有 9 中不同的 AAV 血清型可供客户选择,建议客户针对 不同 组织器官选择相应血清型的 AAV 病毒,见表 1。
血清型 组织亲和性
AAV1 肌肉,心脏,骨骼肌(包括心肌),神经组织
AAV2 中枢神经,肌肉,肝脏,脑组织,眼, AAV3肌肉,肝脏,肺,眼
AAV4 中枢神经,肌肉,眼,脑
AAV5 肺,眼,中枢神经,关节滑膜,胰腺
AAV6 肺,心脏
AAV7 肌肉,肝脏
AAV8 肝脏,眼,中枢神经,肌肉
![]() AAV9 心脏,肌肉,肺(肺泡),肝脏,中枢神经
AAV9 心脏,肌肉,肺(肺泡),肝脏,中枢神经
表1. 9种不同血清型AAV对各组织器官细胞的亲和性
Cell Line |
AAV-1 |
AAV-2 |
AAV-3 |
AAV-4 |
AAV-5 |
AAV-6 |
AAV-8 |
AAV-9 |
AAV-DJ |
AAV-DJ/8 |
Huh-7 | 13 | 100 | 2.5 | 0 | 0.1 | 10 | 0.7 | 0 | 500 | 0.2 |
HEK293 | 25 | 100 | 2.5 | 0.1 | 0.1 | 5 | 0.7 | 0.1 | 500 | 0.3 |
HeLa | 3 | 100 | 2 | 0.1 | 6.7 | 1 | 0.2 | 0.1 | 667 | 0.2 |
HepG2 | 3 | 100 | 16.7 | 0.3 | 1.7 | 5 | 0.3 | ND | 1250 | 0.5 |
Hep1A | 20 | 100 | 0.2 | 1 | 0.1 | 1 | 0.2 | 0 | 400 | 0.1 |
911 | 17 | 100 | 11 | 0.2 | 0.1 | 17 | 0.1 | ND | 500 | 0 |
CHO | 100 | 100 | 14 | 1.4 | 333 | 50 | 10 | 1 | 25000 | 5 |
COS | 33 | 100 | 33 | 3.3 | 5 | 14 | 2 | 0.5 | 500 | 0.3 |
MeWo | 10 | 100 | 20 | 0.3 | 6.7 | 10 | 1 | 0.2 | 2857 | 1 |
NIH3T3 | 10 | 100 | 2.9 | 2.9 | 0.3 | 10 | 0.3 | ND | 500 | 0.1 |
A549 | 14 | 100 | 20 | ND | 0.5 | 10 | 0.5 | 0.1 | 1000 | 0.1 |
HT1180 | 20 | 100 | 10 | 0.1 | 0.3 | 33 | 0.5 | 0.1 | 333 | 0.2 |
Monocytes | 1111 | 100 | ND | ND | 125 | 1429 | ND | ND | 100 | ND |
Immature DC | 2500 | 100 | ND | ND | 222 | 2857 | ND | ND | 200 | ND |
Mature DC | 2222 | 100 | ND | ND | 333 | 3333 | ND | ND | 100 | ND |
表 2. 不同血清型 AAV 感染体外培养细胞比较
四、AAV病毒包装
(一) AAV-293细胞的冻存
1、设置温度为37~42℃的水浴。
2、查看细胞库记录,根据记录从液氮罐中取出冻存的细胞(需戴上棉手套,防 止被冻伤),迅速丢入水浴锅中并快速晃动,尽量在1~2min 内使细胞溶液完全 溶解。
3、将细胞溶液转移到15ml 离心管中,并在其中加上1ml 新鲜的完全培养基,混 匀后离心,1000 rpm/min,5min。
4、去掉上清,加入5ml 新鲜的完全培养基,混匀沉淀后,转入6 cm 培养皿。
5、将培养皿平稳放入37℃、5% CO2 和95%相对湿度的培养箱中培养。
6、第二天观察细胞存活率。给细胞换一下培养基。以后每天观察细胞生长情 况。
(四)AAV包装和浓缩
1. 质粒扩增构建好的AAV载体、包装质粒和辅助质粒需经过大量抽提, 浓度大于1ug/ul, A260/280 在1.7-1.8 间方可用以包毒。推荐使用Qiagen 大抽试剂盒进行质粒的大量去 内毒素抽提。
2. 传AAV-293细胞将培养AAV-293 细胞T75 瓶中的培养基吸净,加入2mL 4 度冰箱取出的0.25%胰酶,使其均匀覆盖瓶底,置于37 度培养箱中3-5min,取出,摇晃可发现细胞于底部脱 离,将其全部晃下,加入3mL 37 度水浴中预热的10% DMEM,移液枪用10mL 移液 管进行吹打,较大力吹打6-8 次即可,不留死角,瓶口处较难吹打可将移液管对准培 口,小力将培养基打出即可覆盖到接近瓶口的细胞。之后,将所有细胞吸出,置于 15mL 离心管中,取50ul 混匀后的细胞于1.5mL eppendorf 管中,加入450ul 10% DMEM,即为10 倍稀释,混匀,取10ul 细胞于计数板中计数。计数板上共4 大格,每 大格16 小格。计数时,4 大格均计数,总数除以4(得每大格细胞数),再乘以10(10 倍稀释),即为实际n 万/mL 细胞浓度。传代当天记为第一天,若第二天进行转 染,铺900-1000 万/T75;若第三天转染,铺350-400 万/T75。每瓶T75 加10mL 10% DMEM 培养基。转染当天观察细胞密度,80-90%满即可进行转染。转染前无需换培 养基。
3. 做脂转complex
试剂名称 | 试剂数量 |
载体质粒 | 5ul(1.0ug/ul) |
包装质粒 | 5ul(1.0ug/ul) |
辅助质粒 | 5ul(1.0ug/ul) |
注:LipofiterTM转染试剂为汉恒生物产品,使用说明参考LipofiterTM说明书。
4. AAV 病毒收毒: 病毒颗粒同时存在于包装细胞和培养上清中。可以将细胞和培养上清都收集下来以获得最好的收率。
1) 准备一个干冰乙醇浴(将乙醇倾入装有干冰的泡沫盒即可,也可用液氮替代干 冰乙醇浴)和37°C 水浴;
1) 向病毒浓缩液中添加固体 CsCl 直到密度为1.41 g/ml(折射率为1.372);
2) 将样品加入到超速离心管中,用预先配好的 1.41 g/ml CsCl 溶液将离心管剩 余空间填满;
3) 在 175,000 g 下离心24 小时,以形成密度梯度。按顺序分步收集不同密度的 样品,取样进行滴度测定。收集富集有AAV 颗粒的组分;
4) 重复上述过程一次。
5)将病毒装入100 kDa的透析袋,4度透析脱盐过夜。此即为纯化的AAV病毒
五、AAV病毒包装滴度测定(采用Q-PCR法)
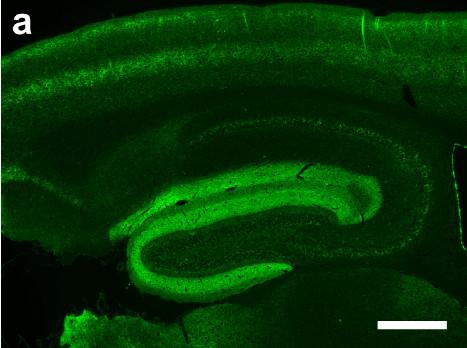
2. AAV2感染大鼠脑组织
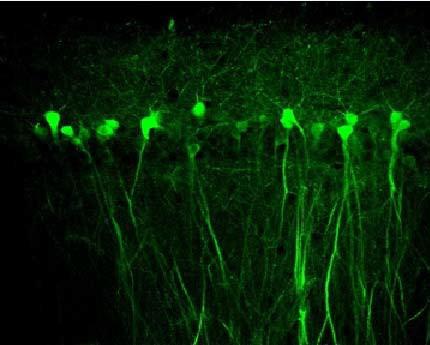
3. AAV感染心脏(PMID: 20703310)
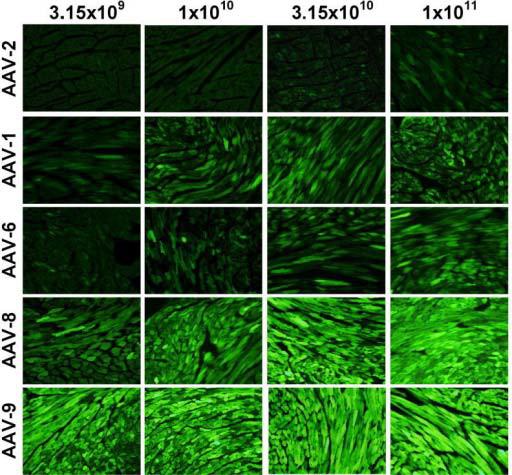
 5. AAV感染肝脏(PMID: 19861950)
5. AAV感染肝脏(PMID: 19861950)
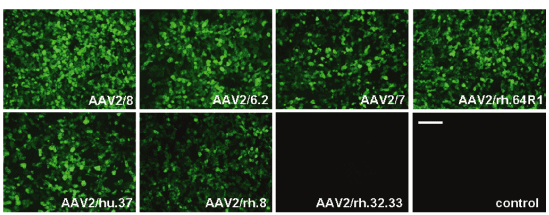
6. AAV9感染骨骼肌(PMID: 21811247)
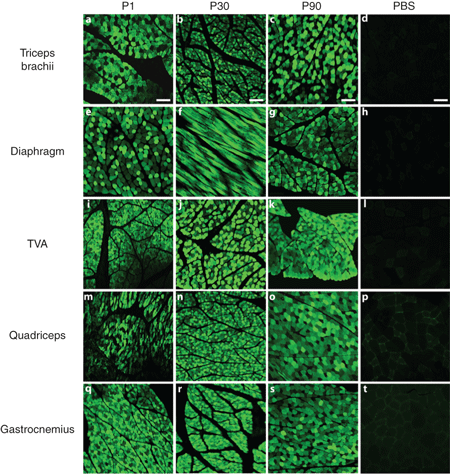
- 浏览 127700 次








