几种细胞死亡方式简述
程序性细胞死亡(Programmed Cell Death, PCD)是有机体在漫长的进化过程中发展起来的细胞自杀机制,在清除无用的、多余的或癌变的细胞,维持机体内环境稳态方面发挥重要作用。程序性细胞死亡调控机制的失调与多种疾病的发生发展相关,如神经变性性疾病、自身免疫病、恶性肿瘤、衰老、病原微生物感染、肌细胞功能失调等。多数学者将细胞的死亡形式分为凋亡性程序性细胞死亡(Apoptosis)、自噬性程序性细胞死亡(Autophagy)和细胞坏死(Necrosis)三种类型。
凋亡性程序性细胞死亡也称为Ⅰ型程序性细胞死亡。对细胞凋亡的形态学、参与分子及调控机制的研究由来已久。凋亡细胞的典型形态学特点表现为:细胞皱缩、体积缩小;部分细胞器、核糖体和核碎片被细胞膜包裹形成凋亡小体,从细胞表面出芽脱落,最后被具有吞噬功能的细胞如巨噬细胞、上皮细胞等吞噬;磷脂酰丝氨酸外翻;细胞核染色质浓缩、边缘化、染色质DNA断裂。凋亡过程重要的参与分子有:凋亡促进分子半胱-天冬氨酸蛋白酶(Caspases)家族、Bax/Bak、细胞色素C等;凋亡抑制分子IAP、Bcl-2家族分子等。凋亡信号通过细胞膜受体途径(Fas/FasL、TNF/TNFR等)或线粒体途径传导,依次激活起始Caspases (Caspase-8或Caspase-9) 和下游信号转导通路的关键分子执行Caspase (Caspase-3), 启动凋亡。另外,凋亡形式的程序性细胞死亡也可以Caspases非依赖的方式进行。细胞坏死是细胞对外界损伤刺激的一种非程序性死亡方式,其形态学特点明显异于凋亡,常伴随炎症的发生。
近年来,一种新的程序性细胞死亡方式-自噬性程序性细胞死亡吸引了越来越多细胞生物学家的注意。人们将Autophagy称为Ⅱ型程序性细胞死亡,这种形式的细胞死亡表现为细胞浆中出现大量包裹着细胞浆和细胞器的空泡结构和溶酶体对空泡内成分的降解。自噬在细胞的生长、发育和疾病发生中起着重要的作用。随着参与自噬性程序性细胞死亡途径的关键分子的鉴定成功,我们对其分子机制、生理功能和在病理过程中的作用有了进一步的了解。2004年12月出版的《科学》杂志预测对自噬性程序性细胞死亡的研究会成为2005年科技领域的六大热点之一,且排在第一位。一份全新的国际性杂志《Autophagy》已在2005年4月份出版,有关自噬研究的第一次国际性会议也已于2005年4月在意大利召开。估计正如当年对细胞凋亡的研究一样,对自噬的关注很快会在生命科学领域形成一个新的研究热点。本综述将就哺乳动物细胞自噬(Autophagy)与自噬性程序性细胞死亡的形态学特点、关键分子加工机制、信号转导、与细胞凋亡的关系、在病理生理过程中的作用及其研究方法展开讨论。
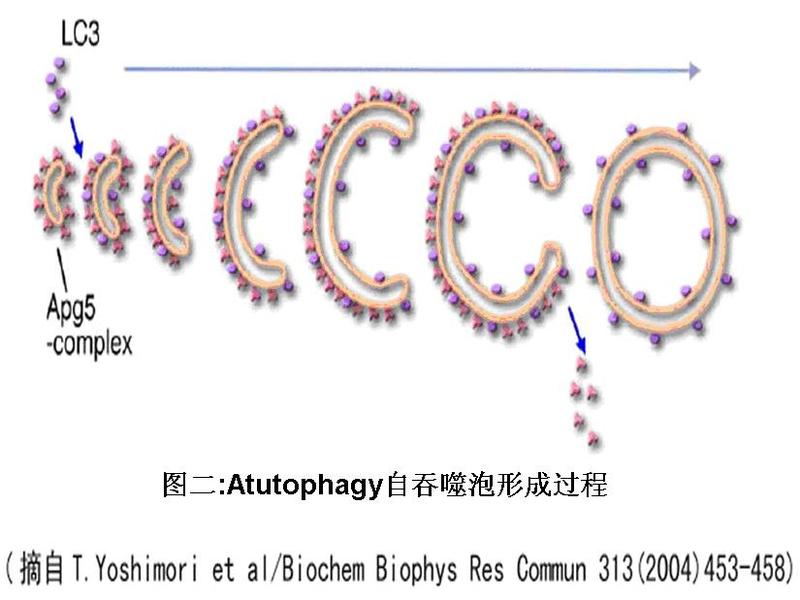
Autophagy 是凋亡之外的第二种程序性细胞死亡方式,在进化过程中高度保守,从酵母、果蝇到脊椎动物和人都可以找到参与autophagy 的同源基因。相对于主要降解短半衰期蛋白质的泛素-蛋白酶体系统,细胞的自噬被认为是参与绝大多数长半衰期蛋白质的降解。在形态学上,即将发生autophagy 的细胞胞浆中出现大量游离的膜性结构,称为前自噬泡(Preautophagosome)。前自噬泡逐渐发展,成为由双层膜结构形成的空泡,其中包裹着变性坏死的细胞器和部分细胞浆,这种双层膜被称为自噬泡(Autophagosome)。自噬体双层膜的起源尚不清楚,有人认为其来源于粗面内质网,也有观点认为来源于晚期高尔基体及其膜囊泡体,也有可能是重新合成的。自噬泡的外膜与溶酶体膜融合,内膜及其包裹的物质进入溶酶体腔,被溶酶体中的酶水解。此过程使进入溶酶体中的物质分解为其组成成分(如蛋白质分解为氨基酸,核酸分解为核苷酸),并被细胞再利用,这种吞噬了细胞内成分的溶酶体被称为自噬溶酶体(Autophagolysosome or Autolysosome)。尽管在进化过程中,底物运送到溶酶体的机制发生了变化,autophagy 本身却是一个进化保守的过程。与其他蛋白水解系统相似,溶酶体参与了细胞内组成成分的持续性转运和翻新(尤其是长半衰期蛋白质的分解和再利用)。在autophagy 过程中,除可溶性胞浆蛋白之外,像线粒体、过氧化物酶体等细胞器或细胞器的一部分,如高尔基体和内质网的某些部分都可被溶酶体所降解;最近,有研究发现,酵母细胞核的某些区域也可通过autophagy 途径被清除。
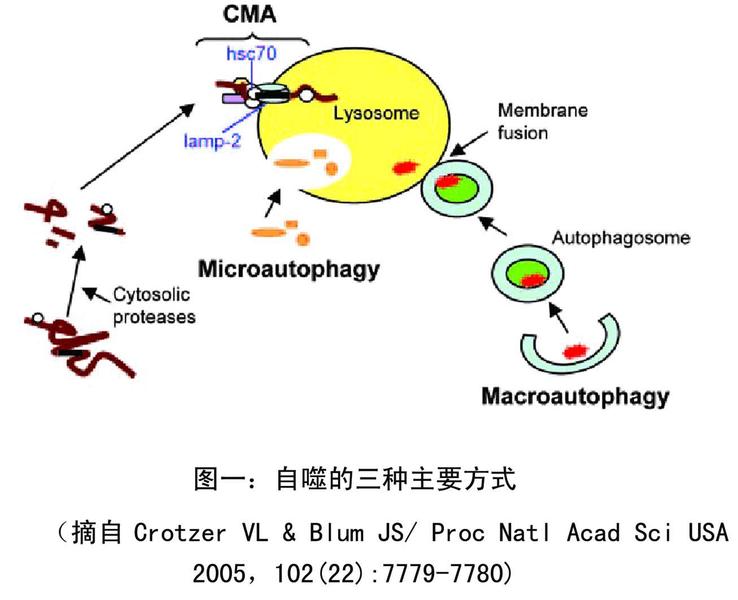
根据细胞内底物运送到溶酶体腔方式的不同,哺乳动物细胞autophagy 可分为三种主要方式:大自噬(Macroautophagy)、小自噬(Microautophagy)和分子伴侣介导的自噬 (Chaperone-mediated autophagy)。在大自噬形式的autophagy中,细胞浆中可溶性蛋白和变性坏死的细胞器被非溶酶体来源的双层膜结构所包裹,即前面提到的自噬泡(Autophagosome),并由自噬泡将其携带到溶酶体中降解加工;小自噬形式的autophagy与之不同,溶酶体膜自身变形,包裹吞噬细胞浆中的底物。在大自噬和小自噬两种形式的autophagy中,底物被其所包裹的膜性结构带至溶酶体后,均发生膜的迅速降解,进而释放出其中的底物,使溶酶体中水解酶对底物进行有效水解,保证了细胞对底物的再利用。分子伴侣介导的自噬首先由胞浆中的分子伴侣Hsc73识别底物蛋白分子的特定氨基酸序列 (如KFERQ-样模体) 并与之结合,分子伴侣-底物复合物与溶酶体膜上的受体Lamp2a (Lysosome-associated membrane protein 2a)结合后,底物去折叠;溶酶体腔中的另外一种分子伴侣介导底物在溶酶体膜的转位,进入溶酶体腔中的底物在水解酶作用下分解为其组成成分,被细胞再利用。因此,自噬可被认为是真核细胞中广泛存在的降解/再循环系统。哺乳动物细胞三种形式autophagy的比较参见图一。
- 浏览 11398 次








