腺病毒包装流程及操作
重组腺病毒是一种复制缺陷的腺病毒载体系统,在基因治疗、基础生命科学研究等领域被广泛应用。重组腺病毒具有以下几个显著优点:感染范围广,几乎可以感染所有的细胞系、原代细胞和部分组织;感染效率高达 100%,可全面超越其他病毒载体工具和脂质体转染;对外源基因容载能力大(可以高达 8Kb);不整合基因组;滴度高,操作方便。因此,重组腺病毒是一种最具有潜力的基因递送工具。
目前常用的腺病毒载体基于人腺病毒5型(Ad5),其基因组是36Kb长的线性双链DNA。腺病毒可通过自身的纤维(fiber)和细胞表面的受体结合被内吞进入细胞,然后从内吞体(endosome)转移到细胞质和细胞核内,借助细胞的转录和翻译机器启动病毒的复制组装。一个完整的病毒生活周期会引发细胞死亡从而释放出病毒粒子。
目前最常用的腺病毒包装体系有AdEasy和AdMAX两种,其共同特点是目的基因首先克隆到穿梭载体,然后再重组到腺病毒的大骨架上。这两个系统均具有腺病毒早期转录复制基因E1和E3的缺陷(ΔE1, ΔE3),其中E3基因对病毒产生并非必需。因此,腺病毒包装必需依赖表达E1的细胞系,例如HEK-293,HEK-293A等。
相对于Adeasy系统,AdMAX系统操作便利,并且可以获得更好的病毒滴度。本操作说明均基于AdMAX系统,该系统由pHBAd系列穿梭质粒、腺病毒骨架载体pBHGlox(delta)E1, 3Cre双载体组成。
一、整体实验流程

二、实验材料
该病毒包装系统为两质粒系统,组成为穿梭质粒(pHBAd系列,包括包括过表达、干扰等类型)和骨架质粒(pBHGlox(delta)E1, 3Cre)。
1、载体信息(见附1)
2、菌株:大肠杆菌菌株DH5α。用于扩增腺病毒载体和腺病毒骨架载体质粒。
3、细胞株:293A,腺病毒的包装细胞,表达腺病毒基因E1,为贴壁依赖型成上皮样细胞,经培养生长增殖形成单层细胞,生长培养基为DMEM+10% FBS+双抗(DMEM完全培养基)。293A细胞来源于一个用作空斑测定的亚克隆,具有易使用和易转染的特性。该细胞株对于高细胞密度很敏感,当细胞超过 70%汇合时,一些细胞可能会丢失它们的表型。
若细胞密度持续在 70% 以下,则293A细胞能连续培养3~4个月维持原有的细胞特性。若以购买得到的293A作为第一代,则30代内都能得到最佳结果。随着传代次数的增加,293A细胞会出现生长状态变差、突变等现象。为了防止此类现象的出现,我们需要在初始阶段对细胞进行大量的冻存保种,以保证实验的稳定性和持续性。在细胞对数生长期进行冻存,可增加细胞复苏成活率。
注:为了达到最好的细胞状态,提高腺病毒出毒效率,推荐在培养基中加入汉恒生物的SaveItTM抗支原体试剂。
三、腺病毒包装和浓缩
(一)质粒构建和扩增
构建有目的基因的腺病毒穿梭质粒和骨架质粒需经过大量抽提,浓度要求大于 1 mg/ml,A260/280在1.7~1.8范围内方可用于病毒包装。推荐使用Qiagen大抽试剂盒进行质粒的大量去内毒素抽提(质粒质量会极大影响后续转染效率和病毒的滴度)。
注:质粒构建推荐使用汉恒生物HB-infusionTM无缝克隆试剂盒。
(二)腺病毒包装
事先准备好用于包装病毒的293A细胞(50-70%的汇合度)和病毒质粒,转染每个直径为6 cm的培养皿成分如下:
DMEM需在 37℃水浴中预热,LipoFiterTM转染试剂需恢复至室温方可使用,并在使用前摇匀。转染 6h后置换成新鲜培养液。
注:1、LipoFiterTM转染试剂为汉恒生物产品,使用说明参考LipoFiterTM说明书。
2、转染前细胞必须处于良好的生长状态。
(三)病毒收集
病毒收集前要观察病毒空斑是否形成。为了限制病毒的扩散而让空斑更好地形成,通常在培养液中加入低熔点琼脂糖,转染后一般在第10至21天可以在显微镜下看到小的空斑。如果穿梭质粒带有荧光蛋白(GFP或RFP),则在空斑形成之前观察荧光,以确定转染效率。空斑形成后将空斑与琼脂糖一起挑起,放入1 ml新鲜培养基中过夜。通常挑取3-6个空斑不等,然后比较滴度,使用滴度最高的一个空斑进行后续实验。
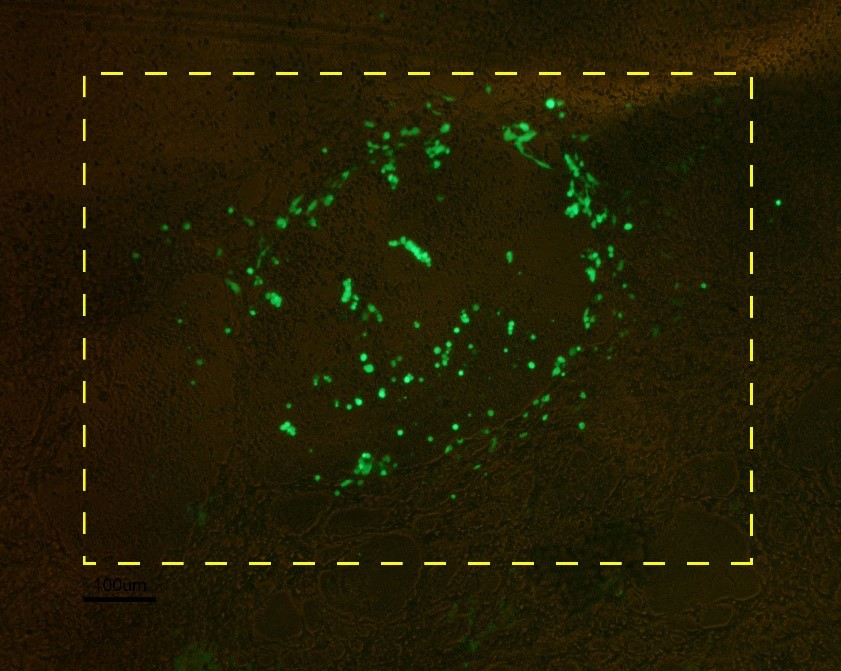
空斑示意图
注:高纯度的低熔点琼脂糖储液可以配制在无菌PBS中,终浓度5%;使用之前用沸水浴完全融化,然后自然降温到45℃待用。用37℃预热的完全培养基稀释5%的琼脂糖溶液到终浓度1.25%,混匀后马上加到去除培养基的细胞上,轻轻地覆盖均匀。6孔板每孔覆盖3 ml琼脂糖/培养基。
(四) 病毒扩增
第二天,将培养基中病毒加入新鲜293A细胞培养液中进行病毒少量扩增。至细胞再次出现空斑,收集细胞及上清,反复冻融三次收集病毒,以此病毒为P1代病毒,以P1代腺病毒感染293A细胞,连续进行三代感染,至P4代进行腺病毒的大量扩增,待空斑形成后收集病毒并对病毒进行体外纯化和浓缩。
注:1、收集细胞的时候一般使用细胞刮,不能用胰酶消化,4℃ 500´g离心10 min,去除大部分上清,只留取 2 ml上清重悬细胞沉淀进行 -80℃(干冰或者液氮均可)冻融。
2、37℃冻融时一旦病毒融化就马上取出,长时间在37℃温育会降低病毒滴度,完全融化后可以剧烈震荡 30s。冻融周期通常会持续2~4次才可以获得高滴度的病毒。
3、细胞冻融结束裂解液可以 4℃ 500×g离心10 min,不立即使用的话可以冻存在 -20℃或 -80℃。
(五)病毒纯化
病毒纯化采用PEG8000沉淀-CsCl密度梯度离心-透析联用法纯化病毒,具体操作如下:
1、融化:提前 1 天将病毒从 -80℃冰箱拿出,室温水浴融化。收集全部细胞裂解物,7000×g 4℃离心10 min,弃细胞碎片,收集上清。
2、PEG8000沉淀:每100 ml上清加入50 ml PEG8000(20% PEG8000,2.5 M NaCl),冰上放置 1h使病毒沉淀(可适当延长时间)。7000×g 4℃离心上述混合物 20 min,弃上清,将沉淀物悬浮在 10 ml 密度为 1.10 g/ml 的 CsCl 溶液中(溶剂为20 mM Tris-HCl,PH8.0)(溶液配置见下表), 病毒液应呈粉红色。
三种不同密度CsCl溶液的配制
密度(g/ml)(20℃) | 浓度(mg/ml) | CsCl的量(g) | 终体积(ml) |
1.40 | 548.3 | 5.483 | 10 |
1.30 | 402.4 | 4.024 | 10 |
1.10 | 143.8 | 1.438 | 10 |
3、CsCl 梯度离心:CsCl 梯度的制备方法如下:加入 2 ml 密度为 1.40 g/ml 的 CsCl 溶液(溶剂同上),然后再缓慢加入 3 ml 密度为 1.30 g/ml 的 CsCl 溶液(配置如下表),再加入 5 ml 的病毒悬浮液。使用Beckman SW28转子,26,000 rpm,4℃离心2小时。

4、收集病毒:用注射器收集密度在 1.30 g/ml 和 1.40 g/ml 之间的病毒条带至透析袋中。
注:透析袋使用前用 10 mM EDTA-Na2煮沸10 min,降至室温使用。
5、透析:在透析缓冲液(50 g 蔗糖,10 ml 1M Tris-HCl,PH8.0,2 ml 1M MgCl2定容至 1L)中,4℃搅拌过夜,中间需更换一次透析液。收集病毒,测定病毒滴度。
6、重悬:500 μl PBS重悬病毒沉淀,一周内使用则置于4℃保存,如需长时间存放需置于-80℃保存。

- 浏览 19499 次








