小鼠尾静脉病毒(腺病毒、慢病毒)注射操作步骤
1、固定
建议自制了一个小圆筒,筒的直径正好容下一直小鼠,筒的一端是盲端,筒身上开了N个通气空,有一个后盖,后盖上留有一圆孔,正好容下尾巴。由于小鼠有钻洞的习性,把它往筒口一放,自己就钻进去了,然后把尾巴从盖孔中穿过,盖上后盖即可。找一张桌子,把尾巴压在桌边沿上,由于边沿是个直角,把尾巴的下1/3处压在直角上能使尾部暴露很好。
2、扩张血管
小鼠尾静脉用热水泡一下或是用75%的酒精擦拭小鼠尾静脉,以使注射前使尾静脉充分充血扩张;或是在上方悬挂一灯泡,在适当距离烤尾静脉也可以使尾静脉充血扩张。
3、注射
小鼠尾静脉共三根,一根背侧,另两根分置于两侧,腹侧是动脉。
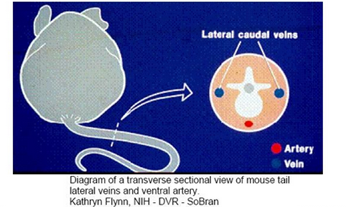
每只小鼠病毒注射量:
以下为建议,具体的注射量需要实验摸索
纯化过腺病毒:1-5×109毒量注射(1),比如纯化腺病毒滴度为1×1011PFU,则每只小鼠注射体积约为10-50ul。
浓缩慢病毒:1-5×107毒量注射,如慢病毒滴度为1×10 8PFU/ml,则小鼠理论上注射100-500ul,实际上每次注射体积有严格要求(见下方),所以如果量不够,需要分多次注射,每次注射至少间隔1-2天。
每只小鼠病毒注射体积:
注射体积不要超过200ul,最好控制在100ul以下,注射剂量过多,也会发生充血性心衰。
关于注射针:一般小鼠尾静脉注射可采用1ml注射器,并更换为4号针头。(不要用1ml注射器配套的针头,太大了!)
建议选用胰岛素注射针(有大小容量,见下图,有很多厂家,图为BD的胰岛素针),可按需选择。

尾静脉 | 大鼠 | 四号针头 | 300ul |
小鼠 | 四号针头 | 100ul |
注意:
1. 一开始最好从小鼠尾静脉的末端开始注射,如果在中前端注射一旦失败这样可以防止注射的数次失败后液体漏出。
2. 注射时手上的感觉很重要,如果针头进入尾静脉,手上会有一种透空感,另外针头如果进入后,液体的推射会很顺利;如果,感觉液体推不进去,很费力,说明针头没有进入尾静脉,而是进入了周围的软组织。
3. 在注射时,一个很重要的原则是注射要缓慢,均匀推射,速度不可以快,一旦速度快,小鼠会发生充血性心衰;如果一旦出现这种情况,立即停止注射,对小鼠实行心脏按摩,也许可以救活。
4.病毒实验带有一定的危险性,为了您的安全和健康,请穿实验服并戴一次性手套,并谨慎小心进行实验操作。
参考文献
1. Wang LJ, Wang J, Li N, et al. Molecular characterization of the NPC1L1 variants identified from cholesterol low absorbers. J Biol Chem 2011; 286(9): 7397-408
- 浏览 82234 次








