SIRT家族生物学功能研究
组蛋白的乙酰化/去乙酰化修饰在基因表达调控中起重要作用。参与去乙酰化的酶除了经典的Ⅰ类和Ⅱ类组蛋白去乙酰化酶(HDAC)外,还有Ⅲ类HDAC,即Sir2相关酶类(Sir2-related enzymes, Sirtuin)。酵母沉默信息调节子2(silent information regulator2, Sir2) 蛋白和它在其他原核和真核生物中的同源(sirtuin) 是一类依赖于NAD+、核心区域高度保守的蛋白去乙酰化酶和ADP核糖基转移酶, 哺乳动物Sirtuin可与p53、FOXO、PGC-1α、NF-κB、Ku70等蛋白相互作用,调控细胞应激反应、代谢、衰老和凋亡等过程。
早在1979年,人们就发现了sir2基因对于维持酵母的交配型、端粒的长度和rDNA编码的DNA重复序列的生成具有非常重要的作用。让研究人员对sirtuin蛋白家族日益重视的原因是后续发现了Sir2 在寿命调控中起重要作用。Sir2基因可以通过抑制基因组的不稳定性延长酵母的寿命,敲除Sir2基因可以显著地缩短酵母的寿命,而额外的一个Sir2 基因拷贝则能延长酵母寿命约40%。后续发现,在线虫中过表达Sir2的同源物Sir2.1能够延长线虫50%的寿命,果蝇中也发现了类似的现象。Sirtuin蛋白家族在卡路里限制(caloric restriction)导致的寿命延长过程中也有着重要作用,但是,2011年在线虫和果蝇中的研究对Sir2和寿命的关系提出了质疑。
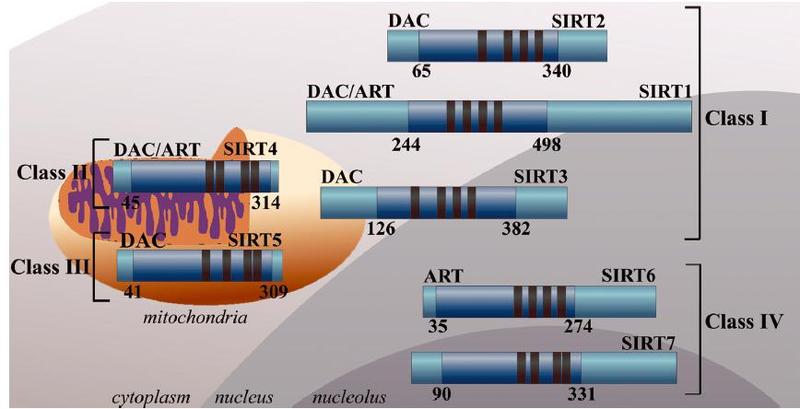
表观遗传主要涉及DNA甲基化、组蛋白修饰及染色体重塑。其中组蛋白共价修饰又包括甲基化/去甲基化、乙酰化/去乙酰化、磷酸化/去磷酸化、泛素化/去泛素化等。乙酰化/去乙酰化主要由组蛋白乙酰化酶(histone acetylase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)分别催化。目前有3 类HDAC,Ⅰ类和Ⅱ类HDAC可被共同的抑制剂,如曲古抑菌素A(trichostatin A)抑制; 而Ⅲ类HDAC被烟酰胺(nicotinamide,NAM)抑制。第1个被发现的Ⅲ类HDAC是芽殖酵母的沉默信息调节因子2(silence information negulator2, Sir2)。随着Sir2同源基因相继在其他物种中克隆,现已将各物种的Sir2 同源蛋白质统称为Sir2相关酶类(Sirtuins)。Sirtuin是一种从细菌到人类高度保守的去乙酰化酶类,人类Sirtuin家族中公认的成员有7个: SIRT1~SIRT7。它们都具有高度保守的NAD+结合域和催化功能域,不同的N端和C端可使它们能够结合不同的底物。Sirtuin蛋白家族可以调节多种蛋白的乙酰化修饰和ADP核糖基修饰。Sirtuin蛋白家族具有不同的亚细胞定位。SIRT1、SIRT 6 和SIRT 7 主要位于细胞核内,SIRT3、SIRT4和SIRT5 定位在线粒体中,而SIRT2主要分布在细胞浆中。这些蛋白的亚细胞定位还取决于细胞类型、状态和分子间相互作用等,如SIRT1和SIRT2可在细胞核和细胞浆之间穿梭,并且与细胞核和细胞浆中的蛋白相互作用。下图为来自维基百科的简要总结关于sirtuin在的分布以及简要功能的介绍。
Class Subclass | Species | Intracellular location | Activity | Function | ||||
| Bacteria | Yeast | Mouse | Human | |||||
I | a | Sir2 or Sir2p, Hst1 or Hst1p | Sirt1 | SIRT1 | nucleus, cytoplasm | deacetylase | metabolism inflammation | |
b | Hst2 or Hst2p | Sirt2 | SIRT2 | cytoplasm | deacetylase | cell cycle, tumorigenesis | ||
| Sirt3 | SIRT3 | nucleus and mitochondria | deacetylase | metabolism | ||||
c | Hst3 or Hst3p, Hst4 or Hst4p | |||||||
| Sirt4 | SIRT4 | mitochondria | ADP-ribosyl transferase | insulin secretion | ||||
II | Sirt5 | SIRT5 | mitochondria | demalonylase, desuccinylase and deacetylase | ammonia detoxification | |||
V | a | Sirt6 | SIRT6 | nucleus | Demyristoylase, depalmitoylase, ADP-ribosyl transferase and deacetylase | DNA repair,metabolism, TNF secretion | ||
b | Sirt7 | SIRT7 | nucleolus | deacetylase | rDNA transcription | |||
| cobB [14] | regulation of acetyl-CoA synthetase [15] | metabolism | ||||||
哺乳动物的Sirtuin蛋白在细胞内的广泛分布表明其功能多样化。可能涉及转录、细胞周期、细胞分化、凋亡、应激、代谢及基因组稳定的调控。Sirtuin家族成员蛋白结构及酶活性X 线晶体衍射揭示,Sirtuin家族多个成员具有相似的分子结构:由大约270个氨基酸残基组成的一大一小两个结构域。大的结构城主要由Rossmann折叠构成;小的结构域含一个锌指结构〔Cys-X-X-Cys-(X)15, 20-Cys-X-X-Cys〕。Sirtuin家族具有去乙酰化酶活性和ADP-核酸转移酶活性。依赖Sirtuin 的去乙酰化反应是将底物乙酰基转移到NAD+的ADP-核糖基部分。同时,1个NAD+分子分裂成1分子烟酰胺(NAM)和1分子O-乙酰基ADP-核糖。Sirtuin介导去乙酰基和NAD+断裂两种催化活性。Sirtuin所具有的ADP核糖转移酶活性是将NAD+的ADP-核糖转移到乙酰化蛋白。Sirtuin的去乙酰化作用ADP-核酸转移作用可能是去乙酰化反应最初所产生的ADP-核糖在随后去乙酰化过程中被添加到底物中去。另外,有一些Sirtuin成员可能仅有ADP-核糖转移酶活性。
关于sirt家族各个成员的细胞内定位:
首先在动物水平敲除SIRT各个家族成员之后的表型如下:
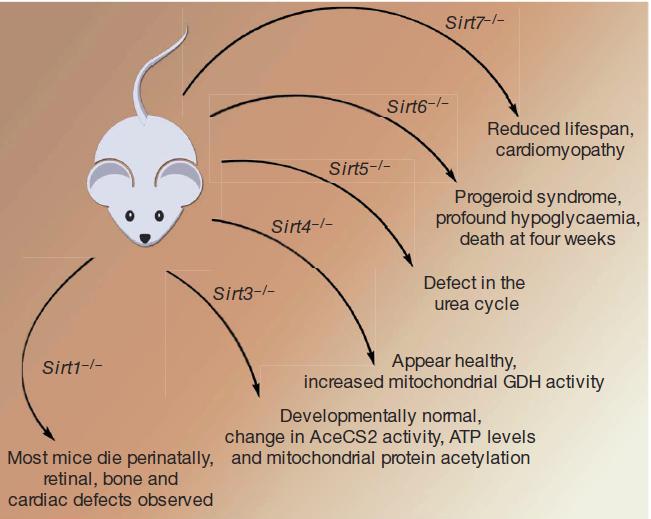
Vol 460j30 July 2009/doi:10.1038/nature08197
在过去的十几年中,对sirtuin蛋白家族生物学功能方面的研究有了长足的进步,其中SIRT1是sirtuin家族中研究最多的一个成员。SIRT1可以去乙酰化组蛋白,还可以去乙酰化很多重要的转录因子和调节蛋白,从而调控多种生物学过程。人类Sirtuin家族中SIRT1与酵母Sir2同源性最高,对其研究也最为深入。
SIRT1 与能量代谢方面: SIRT1可与过氧化物酶体增殖物活化受体γ(PPAR-γ)协同刺激因子a(PGC-1a)及肝细胞核因子4a(HNF4a)结合成一种蛋白复合物,在NAD 参与下,SIRT1通过去乙酰化PGC-1a来激活HNF4a,从而调节糖异生相关基因转录,进而增强肝脏糖异生。另一方面,SIRT1 通过结合PPAR-γ上2个辅助蛋白核受体共抑制蛋白(nuclear receptor corepressor,NCoR)和视黄酸及甲状腺激素受体沉默中介蛋白(silencing mediator of retinoid and hormone receptor, SMRT)抑制PPAR-γ活性,进而在热量摄入减少时,促进白色脂肪组织中的脂肪动员。SIRT1与胰岛素分泌: SIRT1通过抑制解偶联蛋白2(UCP-2来促进胰岛b 细胞分泌胰岛素。UCP-2作为线粒体内膜上的转运蛋白,使线粒体呼吸作用中的氧化磷酸化解偶联。由于此过程中能量以热能形式释放, 使ATP合成减少,此时β细胞内ATP/ADP比值降低。ATP敏感的K+通道开放受其影响所导致的细胞内[Ca2+]下降,抑制了细胞胞吐作用,使胰岛素释放减少。SIRT1与细胞寿命: SIRT1可与多种蛋白相互作用,最初研究认为SIRT1 的主要功能是应激条件下减少细胞凋亡及衰老,增加细胞存活率。SIRT1可负调控肿瘤抑制子p53—这是一种最早发现的SIRT1非组蛋白底物,SIRT1将p53中382位Lys残基去乙酰化,降低p53与DNA顺式元件结合力, 减少由其诱导的细胞凋亡。因此,SIRT1也被看作为一种有潜力的肿瘤激动子。SIRT1与肿瘤多药耐药: SIRT1在许多耐药的肿瘤株中高表达。最近研究表明,SIRT1在肿瘤耐药中的作用可能主要与其能靶向并调节肿瘤抑制子p53、p73、E2F1 和FOXO3a 的活化相关。换言之,在SIRT1依赖的转录因子去乙酰化用于调节基因表达期间,细胞避开了化疗药物所致的增殖阻滞和细胞死亡。
关于sirt1近几年研究表明在细胞的代谢、分化和存活各方面都伴有重要的角色,如下图:
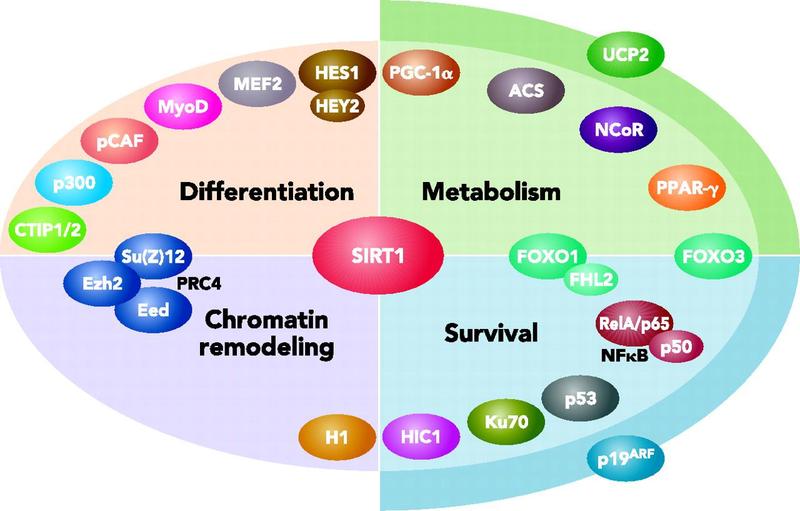
Physiology December 1, 2006 vol. 21 no. 6404-410
Interacting partners, substrates, and downstream effectors of SIRT1
有丝分裂过程中的磷酸化可稳定SIRT2,此时SIRT2 移入核内并与染色质共定位。核内SIRT2 可将H4-K16 去乙酰化,从而使G2/M 期的H4-K16 乙酰化水平降低。由于H4-K16 乙酰化有助于染色质凝聚,SIRT2 过表达将延迟细胞从分裂期退出。SIRT2 作为一种分裂期检查点蛋白通过H4-K16 去乙酰化来实现在分裂应激时阻止染色质凝聚。这提示它可能作为一种分裂期检查点蛋白在DNA 损伤时来调控细胞分裂。SIRT2 还与微管蛋白共定位于胞浆,并将a-微管蛋白去乙酰化,并在此过程中与HDAC6 共同发挥作用。而微管蛋白去乙酰化的生理意义尚不清楚,乙酰化可能影响微管稳定性。SIRT2 在热量限制(caloric restriction, CR)的小鼠肾脏和白色脂肪组织中表达增加。另外,H2O2处理的氧化应激也可增加SIRT2 表达。SIRT2 将FOXO3a 去乙酰化后可增强FOXO 与DNA 结合力进而提高FOXO 靶基因p27(Kip1)、锰超氧化物歧化酶和Bim 的表达水平, 最终降低细胞内反应性活性氧水平。此外,由于Bim 是一种前凋亡因子,所以SIRT2 在细胞处于应激状态时,可刺激细胞死亡。因此,在CR和氧化应激时,SIRT2 可反应性地将FOXO 去乙酰化来保护机体免于活性氧的损伤。去年发表于Nature的一篇文章显示:SIRT2是细胞死亡的一个调控因子死亡配体TNF-T通过刺激一个包含“受体相互作用蛋白通通” (RIP1)和“受体相互作用蛋白(RIP3)的复合物的形成来激发坏死。Toren Finkel及其同事通过对小鼠进行研究发现,“依赖于NAD的脱乙酰基酶” SIRT2作为组成成分结合到RIP3上。如果没有SIRT2,RIP1–RIP3复合物不会在TNF-T刺激后形成,坏死就不会发生。RIP1是依赖于SIRT2的脱乙酰化作用的目标,其乙酰化作用调控RIP1–RIP3复合物的形成和TNF-T刺激的坏死。在“缺血在再灌注”受伤过程中(在该过程中坏死普遍发生),RIP1被以依赖于SIRT2的方式脱乙酰。本文作者进而发现,缺失Sirt2基因的心脏或用SIRT2的药物抑制因子处理过的心脏基本上会受到保护而不发生缺血性受伤。因此,SIRT2是程序化坏死的一个重要调控因子,是防止坏死性受伤中一个有希望的药物作用目标。
Inhibition of SIRT2 protects against ischaemia-reperfusion injury.
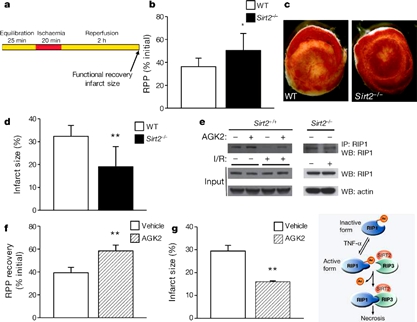
N Narayan et al. Nature 000, 1-6 (2012) doi:10.1038/nature11700
SIRT3是第1个被定位于哺乳动物细胞线粒体的Sirtuin。 SIRT3在富含线粒体的组织如肌肉、肝、肾和心中高表达,在脑、肝、脾、肾、心、骨骼肌、胸腺、肺、骨髓、子宫和卵巢等脏器中均检测到SIRT3 mRNA的表达。SIRT3可去乙酰化并激活一种线粒体基质酶—乙酰CoA合成酶2。在乙酰CoA消失时,该酶可活化醋酸盐代谢。有研究表明,当SIRT3和SIRT5共表达于细胞时,SIRT3将从线粒体移入细胞核。在体外,SIRT3可将一些非线粒体定位的蛋白质如组蛋白H4、微管蛋白等去乙酰化。有报道表明,CR时,SIRT3表达量增加。此时SIRT3不仅通过去乙酰化作用使SOD2活化, 它还可调节异柠檬酸脱氢酶2(IDH2)的活化,进而减少氧化应激所致的DNA损伤。另外,SIRT3还可在体内和体外将基质酶谷氨酸盐脱氢酶(GDH)去乙酰化。这些酶的活化可提供更多的呼吸链、三羧酸循环及糖原合成的中间产物。Yang等发现,线粒体核糖体蛋白L10(MRPL10)的乙酰化可增加Sirt3-/-小鼠线粒体核糖体的转录活性。推测线粒体蛋白合成是通过线粒体核糖体可逆性乙酰化来实现的。Angela等发现SIRT3 可与线粒体渗透转运孔(mPTP)中的亲环蛋白相互作用,并直接调节亲环蛋白并阻止mPTP开放, 这也说明SIRT3的基本功能是抑制mPTP开放和随后发生的线粒体功能失调。正常心肌组织中,SIRT3可靶向亲环蛋白,并保持它处于去乙酰化状态,因此可阻止衰老和心肌应激所致的mPTP 开放; 但在SIRT3-/-小鼠中, 亲环蛋白高度乙酰化导致了mPTP开放。随着时间推移,SIRT3活性的降低,也解释了线粒体渗透性转移的增加和心肌功能随年龄的衰退。Sundaresan等鉴定出Ku70为SIRT3的靶蛋白,SIRT3将Ku70去乙酰化, 这将促使Ku70与前凋亡蛋白Bax相互作用。因此,在应激反应时,SIRT3表达增多部分通过阻碍Bax转位到线粒体来保护心肌细胞免于损伤。Finley等发现,SIRT3可破坏控制糖分解基因表达的转录因子HIF1a 稳定性来介导代谢。SIRT3的缺失可增加活性氧产生,这将促进HIF1a稳定。在人乳腺癌细胞中SIRT3表达降低、SIRT3的缺失与HIF1a 靶基因的上调表达相关。SIRT3过表达可抑制糖酵解和乳腺细胞增殖。线粒体SIRT3 因其可抑制活性氧产生和调节HIF1a 被称作肿瘤抑制子。原代小鼠胚胎成纤维细胞或表达有SIRT3 siRNA的肿瘤细胞表现出增殖潜能和HIF1a 稳定性增加。SIRT3过表达可抑制缺氧时HIF1a蛋白的稳定性,削减HIF1a 转录活性。重要的是,SIRT3过表达可降低异种移植物的肿瘤发生。Hallows等发现,SIRT3可直接将鸟氨酸氨基甲酰转移酶(OCT)去乙酰化并将其活化。OCT是鸟氨酸循环合成尿素过程中的一个酶,特异性地存在于肝脏,是反映肝脏细胞状态的一个有效指标。CR的小鼠出现SIRT3增加,这将OTC去乙酰化并活化。SIRT3 可直接调节OTC活性并激活CR时尿素循环。提示低能量摄入时SIRT3可通过激活氨基酸分解代谢和β氧化来调节线粒体。
SIRT4 是另一个调节能量代谢的线粒体蛋白。它没有去乙酰基酶活性,只有ADP-核糖基转移酶活性。与SIRT3依赖的GDH去乙酰化活化相比,SIRT4可使线粒体基质中的GDH 失活。胰腺中SIRT4 依赖的GDH抑制可下调氨基酸刺激的胰岛素分泌。代谢改变是以CR为特点的SIRT3上调, 与CR中SIRT1和SIRT3上调相比,SIRT4在CR中下调。SIRT4基因敲除小鼠的胰岛可分泌高水平的胰岛素,提示SIRT4可通过抑制GDH活性来下调胰岛素分泌,提示可利用SIRT4抑制GDH的活性来预防糖尿病及衰老。SIRT4水平下调时,肝细胞线粒体和脂肪酸代谢的酶基因表达增加。体内外实验表明,SIRT4基因敲低也将引起SIRT1 在mRNA和蛋白水平的表达增加。与对照组相比,SIRT4敲低的原代肝细胞中脂肪酸氧化基因表达显著增加,此效应也依赖SIRT1。因此,抑制SIRT4 可增加肝脏的脂肪氧化能力及骨骼肌中线粒体功能,这也将为我们治疗2型糖尿病提供依据。
SIRT5为一单拷贝基因,含8个外显子。其中,2~8外显子编码Sirtuin催化中心,1 位外显子编码N端序列。表达序列标签数据库分析表明,SIRT5除在心肌细胞及胸腺中表达外, 还在淋巴母细胞大量表达,提示SIRT5基因的染色体断裂可引起粒细胞白血病。SIRT5可将细胞色素C去乙酰化。在体内,去除细胞色素C 的乙酰化可影响它在呼吸及凋亡中功能。SIRT5定位于线粒体基质,并与氨基甲酰磷酸盐合成酶(CPS1)相互作用,CPS1通过催化尿素循环中的起始步骤来完成氨的去毒。SIRT5可使CPS1去乙酰化并上调其活性。禁食时,肝线粒体中的NAD增加,将会引发SIRT5将CPS1去乙酰化来适应氨基酸代谢增加。SIRT5敲除的小鼠在禁食时因CPS1活性不能上调,导致血液中氨浓度增高。另外,SIRT5可能参与慢性酒精中毒所引起的肝损伤。酒精蓄积导致一些已知的Sirtuin底物(p53,tublin)高度乙酰化。这些底物中没有SIRT5底物,可能是我们对已知这些底物了解有限。肝脏的SIRT5表达水平在饮酒后明显降低, 提示SIRT5参与酒精依赖的蛋白高度乙酰化。SIRT5在肝线粒体能量及氨基酸代谢中的作用提示,SIRT5活性改变可能引起饮酒所致的病理变化,具体细节仍需进一步研究。
SIRT6是异常染色质相关核蛋白,参与碱基切除修复(BER)。SIRT6高表达于大脑和骨骼肌。在体外,它不但具有去乙酰化酶活性,还有强大的ADP-核糖基转移酶活性SIRT6-/-成纤维细胞及SIRT6-/-小鼠胚胎干细胞复制率降低。SIRT6-/-细胞常表现出BER缺陷引起的多种染色体缺陷,如片段化、不完整中心粒、缺口及移位。SIRT6-/-小鼠也出现早衰症状,通常会在出生后几周死亡。推测SIRT6可能是一个肿瘤抑制基因,通过调节基因组稳定从而使机体免于肿瘤及衰老发生,它的缺失将引发突变聚集。SIRT6还可保护饮食性肥胖所致的病理性损伤。与野生型小鼠相比,高脂饮食饲养的SIRT6基因过表达小鼠表现为葡萄糖耐受性增加和葡萄糖刺激的胰岛素分泌增多。研究发现SIRT6缺乏导致葡萄糖转运体1和4更多地与膜结合,进而增加葡萄糖摄入。SIRT6通过抑制许多包括胰岛素受体IRS1和IRS2在内的上游分子来负调控AKT 473位丝氨酸和308位苏氨酸的磷酸化。SIRT6 缺乏时,可通过增强胰岛素信号来活化AKT引起低葡萄糖血症。研究揭示了SIRT6 通过调整胰岛素敏感性来调节葡萄糖代谢。Kaidi 等发现,SIRT6 可促进DNA 同源重组过程DNA 双链缺口(DSB)修复中关键环节—再交叉终止。再交叉蛋白CtIP 是SIRT6 的相互作用蛋白,SIRT6依赖的CtIP 的去乙酰化可激活再交叉。当SIRT6缺失后将损坏重组蛋白A与DSB处的单链DNA 结合,这将降低DNA的同源重组率。由此可见,SIRT6在DNA同源重组中发挥重要作用, 它正是通过这种方式来维持基因组稳定。SIRT6缺乏的小鼠基因组不稳定。这是由于哺乳动物细胞在受到氧化应激时,SIRT6就被集中到DNA的双链断裂(DSB)处,同时刺激DSB修复。其间,SIRT6 可结合多聚腺苷二磷酸核糖聚合酶1(PARP1),因此在细胞氧化应激过程中可通过激活PARP1的聚ADP核糖酶活性来加强DSB 修复。Kim等发现,SIRT1可在SIRT6启动子上与FOXO3a和NRF1形成复合物,可正调控SIRT6的表达,进而通过去乙酰化位于此过程的许多基因启动子组蛋白H3上第9位的赖氨酸来负调控糖酵解、甘油三酯合成和脂肪代谢。与正常人肝脏相比,人脂肪肝内的SIRT6表达水平较低,提示SIRT6在脂肪代谢中具有关键作用,这也是将SIRT6作为一个脂肪肝治疗靶点的依据。
研究发现,SIRT7定位于核仁,不仅广泛表达于小鼠增殖组织如肝、睾丸和脾,也在非增生组织如心、脑和骨骼肌中低水平表达。SIRT7 无去乙酰化酶活性及ADP-核糖基转移酶活性,它通过与RNA聚合酶Ⅰ(Pol Ⅰ)相互作用参与激活rRNA 基因转录。SIRT7 基因过表达可增加Pol Ⅰ介导的转录。SIRT7基因敲除可阻滞细胞增殖并启动凋亡。结果提示,SIRT7是Pol Ⅰ转录的激活因子,它也是哺乳动物细胞生存所必需。研究发现SIRT7 缺陷小鼠平均寿命和最大寿命均降低,同时易患心肌肥大和炎症性心肌病。SIRT7缺陷的原代心肌细胞的基础凋亡率约增加200%,同时出现明显的对氧化及基因毒性应激抵抗性降低。提示,SIRT7 具有调节心脏应激反应及细胞凋亡的关键作用。小鼠胚胎癌细胞系P19 细胞在稳定转染SIRT7后,生长速度明显减慢,同时还出现了G1到S 期细胞周期阻滞。因此可推测SIRT7对P19细胞具有明显的生长抑制作用。
- 浏览 26579 次