腺相关病毒载体操作手册
一、实验流程
制备腺相关病毒穿梭质粒,分别高纯度无内毒素抽提腺病毒穿梭质粒和骨架质粒,共转染293A细胞,转染后6h更换为完全培养基,培养十几天,在中间四五天左右更换一次新鲜培养基,然后收集细胞和1ml培液置于15ml离心管后,液氮/37度冻融三次(冻-融要彻底),2000rpm离心5分钟,取上清即为病毒液初代原液。连续三代反复扩增收集病毒后,行病毒的大量扩增,然后通过CsCl密度梯度离心-透析联用法纯化病毒。
二、实验材料
(一)腺相关病毒载体、包装细胞和菌株
该病毒包装系统为两质粒系统,组成为穿梭质粒(包括pHBAd-CMV-IRES-GFP,pHBAd-CMV-IRES-RFP,pHBAd-U6-GFP,pHBAd-U6-RFP)和骨架质粒pBHGlox(delta)E1,3Cre。其中穿梭质粒pHBAd-CMV-IRES-GFP和pHBAd-U6-GFP能表达绿色荧光蛋白(GFP)。pHBAd-CMV-IRES-RFP和 pHBAd-U6-RFP能表达红色荧光蛋白(RFP)。
1、载体信息(见附录)
2、细胞株 293A,腺病毒的包装细胞,为贴壁依赖型成上皮样细胞,经培养生长增殖形成单层细胞,生长培养基为DMEM(含10% FBS)。
3、菌株 大肠杆菌菌株DH5α。用于扩增腺病毒载体和腺病毒骨架载体质粒。
三、包装细胞293A细胞的培养
(一) 293A细胞的冻存
293A细胞来源于一个用作空斑测定的亚克隆,具有易使用和易转染的特性。该细胞株对于高细胞密度很敏感,当细胞超过70%汇合时,一些细胞可能会丢失它们的表型。若细胞密度持续在70%以下,QBI-293A细胞则能连续培养3~4个月维持原有细胞特性。若以购买得到的293A作为第一代,则30代内能得到最佳结果。随着传代的次数增加,293A细胞会出现生长状态下降、突变等。为了防止此类现象的出现,我们需要在开始就对细胞进行大量冻存,以保证实验的稳定性和持续性。在细胞对数生长期进行冻存,增加细胞复苏成活率。
1、去掉上清液,加入PBS洗去残留的培养基;
2、加入0.25%的胰酶,消化1~2min后,镜下观察细胞变圆,细胞间间隙加大时,去除胰酶,加入新鲜培养基吹打混匀,移入离心管中。
3、细胞计数,将细胞全部晃下,加入 3mL 37℃ 预热的10%DMEM,用10mL 移液管进行吹打,较大力吹打 6-8 次即可,不留死角,之后,将所有细胞吸出,置于15mL 离心管中,取 50ul 混匀后的细胞于 1.5mLeppendorf管中,加入 450ul 10% DMEM,即为10倍稀释,混匀,取10ul细胞于计数板中计数。计数板上共4大格,每大格16小格。计数时,4大格均计数,总数除以4(得每大格细胞数),再乘以10(10倍稀释),即 为实际n万/mL细胞浓度。
4、细胞离心,1000rpm,5min。去掉上清。
5、根据细胞计数结果加入细胞冻存液(70%完全培养基+20%FBS+10%DMSO),重悬细胞,密度为3 x106个/ml。
6、分装进细胞冻存管,放入冻存盒中,放入-80℃超低温冰箱。
7、第二天将细胞放于液氮罐中长久保存,并作记录。保存过程中,要不时复苏细胞检测细胞存活率,观察细胞状态等。
(二)293A细胞的传代
当细胞生长到汇合率达到80%~90%时需要对细胞进行传代操作,以扩大细胞数量,维持细胞良好的生长状态。
1、消化细胞,方法同细胞冻存。
2、细胞离心结束后,加入完全培养基重悬。
3、根据具体情况,将细胞分到10cm培养皿中,每个培养皿补足到10ml培养基。
4、将培养皿平稳放回37℃、5%CO2和95%相对湿度的培养箱中培养。
(三)293A细胞的复苏
当细胞传代次数过多,细胞状态变差时,或者细胞出现污染事故时,需要丢弃并对最初冻存的细胞进行复苏。
1、设置温度为37~42℃的水浴。
2、查看细胞库记录,根据记录从液氮罐中取出冻存的细胞(需戴上棉手套,防止被冻伤),迅速丢入水浴锅中并快速晃动,尽量在1~2 min内使细胞溶液完全溶解。
3、将细胞溶液转移到15ml离心管中,并在其中加上1ml新鲜的完全培养基,混匀后离心,1000rpm,5min。
4、去掉上清,加入5ml新鲜的完全培养基,混匀沉淀后,转入6cm培养皿。
5、将培养皿平稳放入37℃、5%CO2和95%相对湿度的培养箱中培养。
6、第二天观察细胞存活率。给细胞换一下培养基。以后每天观察细胞生长情况。
四、腺病毒包装、扩增和纯化
(一)腺病毒包装
事先准备好用于包装病毒的293A细胞和病毒质粒,转染每个直径为6cm的培养皿complex成分如下:
穿梭质粒 | 2μg |
p-BHG(delta)E1,3 cre | 4μg |
DMEM需在37度水浴中预热,LipoFiterTM转染试剂需恢复至室温方可使用,使用前需摇匀。转染后6h换新鲜培液。
注:LipoFiterTM转染试剂为汉恒生物产品,使用说明参考LipoFiterTM说明书。
转染前细胞必须处于良好的生长状态。
病毒实验带有一定的危险性,为了您的安全和健康,请穿实验服并戴一次性手套,在生物安全柜里进行实验操作。
(二)病毒收集
病毒收集前要观察病毒空斑是否形成,为限制病毒的扩散及空斑更好的形成,通常在培养液中加入琼脂糖,感染后7天左右可以在显微镜下看到小的空斑,一般在10至21天内形成,空斑形成后连着琼脂糖一起将空斑挑起,放入新鲜培养基中过夜。
(三) 病毒扩增
第二天,将培养基中病毒加入新鲜293A细胞培养液中进行病毒少量扩增。至细胞再次出现空斑,收集细胞及上清,反复冻融三次收集病毒,以此病毒为P1代病毒,以P1代腺病毒感染293A细胞,连续进行三代感染,至P4代进行腺病毒的大量扩增,待空斑形成后收集病毒并对病毒进行体外纯化和浓缩。
(四)病毒纯化
病毒纯化采用CsCl密度梯度离心-透析联用法纯化病毒,CsCl梯度的制备方法如下:加入2.0ml密度为1.40g/ml的CsCl溶液(溶剂同上),然后缓慢加入3.0ml密度为1.30g/ml的CsCl溶液,再加入5ml的病毒悬浮液。20000rpm,室温离心2小时。
收集密度在1.30g/ml和1.40g/ml之间的病毒条带至透析袋中(透析袋使用前用10mM的EDTA-Na2煮沸10min)。在透析缓冲液(50g蔗糖,10ml 1M Tris-HCl,PH8.0,2ml 1M MgCl2定容至1L)中,4℃搅拌透析过夜,中间换一次透析液。收集病毒,测定病毒滴度。
(五)病毒重悬和保存
500ul PBS重悬病毒沉淀,一周内使用则置于4度冰箱保存,如需长时间存放需置于-80度甚至液氮保存。
五、感染目的细胞
因为不同细胞的MOI不同,所以在将病毒感染正式感染目的细胞前,需要做一个预实验以确定目的细胞中加入的病毒数。
(一)细胞准备
将状态良好的目的细胞接种到24孔板,使细胞浓度为1×105/ml细胞,接种细胞数量因细胞的生长速度而略有不同,一般是保证第二天进行病毒感染的时候细胞汇合率介于50%至70%直接。
(二)病毒感染
I、贴壁细胞
感染实验分为两组,分别添加相应腺体病毒载体和等滴度同体积的对照病毒载体,1/2体积培养液感染(详见下表格)。加入的病毒量范围在MOI=20~50内,每个MOI值加两个孔 2小时后换液。
病毒小培养体积感染表 | |||
培养皿类型 | 表面积/cm2 | 对应细胞培养液体积 | 病毒感染对应细胞培养液体积 |
96-well | 0.3cm2 | 100ul | 50ul |
24-well | 2cm2 | 500ul | 250ul |
12-well | 4cm2 | 1ml | 500ul |
6-well | 10cm2 | 2ml | 1ml |
60mm | 20cm2 | 4ml | 2ml |
100mm | 60cm2 | 10ml | 5ml |
慢病毒感染4小时后补足至培养体积,感染24小时后换液,腺病毒感染2小时后直接换液 | |||
II、悬浮细胞
上面介绍的是针对贴壁细胞的感染方法,若是悬浮或半悬浮细胞,则需要通过平角离心转染法,即将适量的病毒液加入细胞培养皿后,封好口,放入平角离心机后,低速离心1h,然后放入培养箱中正常培养即可。若由于实验条件有限,没有平角离心机,可用离心管代替,将细胞吹打吸入离心管中,进行低速离心,去掉大部分上清,然后加入适量的病毒液,室温放置10min(不能超过半小时),然后将细胞和病毒液同时吸出转入培养皿中继续病毒感染至2小时后换液即可。
(三)观察感染情况
感染24小时后,可以开始观察到GFP/RFP表达(只对于有GFP/RFP独立表达框的腺病毒载体),过表达和干扰的感染时间以36-48小时实验为最佳。
六、动物实验
例子:小鼠尾静脉注射
将纯化过的腺病毒以每只小鼠 1-5×109毒量注射,比如纯化腺病毒滴度为 1×1011PFU,则每只小鼠注射体积约为 10-50ul。具体的注射量需要实验摸索,注意注射体积不要超过 200ul,最好控制在100ul以下,注射剂量过多,也会发生充血性心衰。
其他病毒动物实验可与我们的动物实验工程师沟通细节寻求帮助。
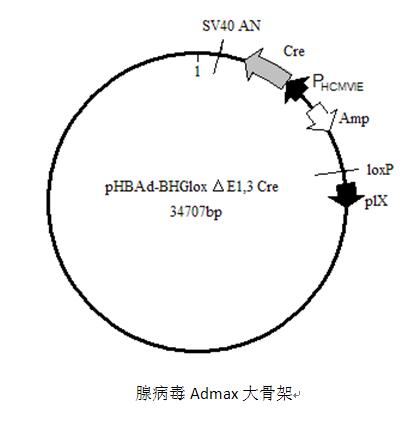
附1:汉恒生物腺病毒质粒图谱
大骨架质粒
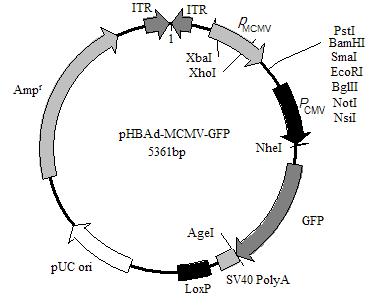
表达质粒 过表达 单标

腺病毒过表达载体,RFP标记
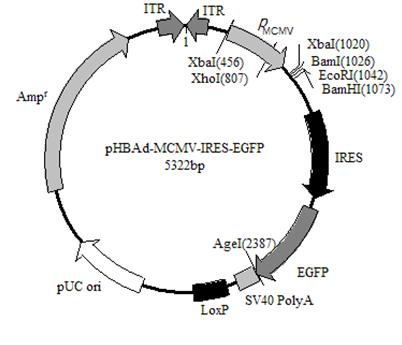
腺病毒过表达载体,GFP标记

腺病毒过表达载体,LacZ标记 腺病毒过表达载体, Luc标记
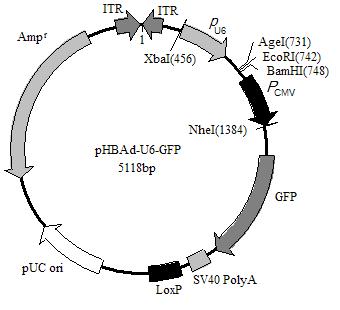
腺病毒过表达载体,GFP标记
干扰
单标记
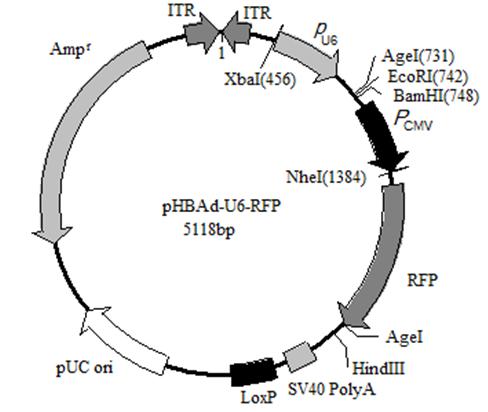
腺病毒干扰载体, GFP标记 腺病毒干扰载体,RFP标记

腺病毒干扰载体,LacZ标记 腺病毒干扰载体, Luc标记
双标记
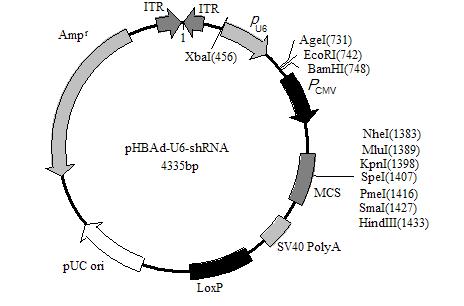
干扰/过表达双表达框腺病毒载体
附2:
汉恒生物腺病毒感染复数(MOI)与体积对应表 | |||||
规格 | 大约数目 | MOI值 | 加入病毒数量 | 腺病毒 | MOI摸索时的体积梯度/ul |
96well | 2-5×104 | 50-100 | 1-5×106 | 0.1-0.5ul | 0.1;0.3;1 |
48well | 1-2×105 | 50-100 | 0.5-2×107 | 0.5-2ul | 0.5;2;6 |
24well | 2-3×105 | 50-100 | 1-3×107 | 1-3ul | 1;3;10 |
12well | 5×105 | 50-100 | 2.5-5×107 | 2.5-5ul | 2.5;7.5;25 |
6well | 1-2×106 | 50-100 | 0.5-2×108 | 5-20ul | 5;15;50 |
35mmdish | 1-2×106 | 50-100 | 0.5-2×108 | 5-20ul | 5;15;50 |
60mmdish | 2-4×106 | 50-100 | 1-4×108 | 10-40ul | 10;30;100 |
100mmdish | 6-10×106 | 50-100 | 3-10×108 | 30-80ul | 30;100;300 |
150mmdish | 1-2×107 | 50-100 | 0.5-2×109 | 50-200ul | 60;180;600 |
腺病毒滴度以1010/ml为准,其他滴度需相应换算; 大约细胞数目是根据80%~100%细胞密度估算而出,具体细胞数请种细胞时进行细胞计数。 | |||||
注:
1)24板长满了细胞大约有3×105个细胞。 如果一天后要长到70%(2.1×105), 建议1.2-1.4×105个细胞。因为细胞刚放进去的前几个小时需要粘在生长表面及适应新的生长条件,不会达到24小时翻一倍的速度。其他规格培养可参照此确定相应culture细胞量。
2)MOI值: MOI 是multiplicity of infection的缩写,中文译为感染复数,实际的含义即为每个细胞被多少个有活力病毒所感染。各种细胞的最适MOI值有差别,请
客户正式实验前先进行预实验摸索最适MOI。
附2:汉恒生物各病毒载体感染目的细胞比较
| 腺病毒 | 慢病毒 | 逆转录病毒 |
感染方式 | 直接加入 | 直接加入 | 直接加入 |
换液时间 | 感染后2h | 感染后24h | 感染后24h |
是否需要筛选 | 不需要,腺病毒感染能力很强 | 需要筛选获得稳定感染株,慢病毒的感染能力不强 | 需要筛选获得稳定感染株,逆转录病毒的感染能力不强 |
观察时间 | 如带有GFP等荧光标签,24h后可观察到荧光,36h可达到表达高峰,若不带有荧光标签,则需要鉴定 | 带有GFP等荧光标签,24h后可以观察到表达,36h达到高峰,若不带有荧光标签,则不可直接观察到,需要鉴定 | 带有GFP等荧光标签,24h后可以观察到表达,36h达到高峰,若不带有荧光标签,则不可直接观察到,需要鉴定 |
是否需要助转剂 | 不需要 | 有时需要,但是根据具体情况操作,因为助转剂,如polybrene,对细胞的伤害比较大,有的细胞可能承受不了 | 有时需要,但是根据具体情况操作,因为助转剂,如polybrene,对细胞的伤害比较大,有的细胞可能承受不了 |
附3:各种病毒载体感染目的细胞操作区别
| 腺病毒 | 慢病毒 | 逆转录病毒 |
感染方式 | 直接加入 | 直接加入 | 直接加入 |
换液时间 | 感染后2h | 感染后24h | 感染后24h |
是否需要筛选 | 不需要,腺病毒感染能力很强 | 需要筛选获得稳定感染株,慢病毒的感染能力不强 | 需要筛选获得稳定感染株,逆转录病毒的感染能力不强 |
观察时间 | 如带有GFP等荧光标签,24h后可观察到荧光,36h可达到表达高峰,若不带有荧光标签,则需要鉴定 | 带有GFP等荧光标签,24h后可以观察到表达,36h达到高峰,若不带有荧光标签,则不可直接观察到,需要鉴定 | 带有GFP等荧光标签,24h后可以观察到表达,36h达到高峰,若不带有荧光标签,则不可直接观察到,需要鉴定 |
是否需要助转剂 | 不需要 | 有时需要,但是根据具体情况操作,因为助转剂,如polybrene,对细胞的伤害比较大,有的细胞可能承受不了 | 有时需要,但是根据具体情况操作,因为助转剂,如polybrene,对细胞的伤害比较大,有的细胞可能承受不了 |
附4:汉恒生物病毒包装周期表
| 腺病毒 |
| 慢病毒 | ||
过表达 | 干扰 | 过表达 | 感染 | ||
目的序列获得 | 3~5天 | 2~4天 | 目的序列获得 | 3~5天 | 2~4天 |
穿梭质粒构建 | 3~12天 | 3~12天 | 重组表达质粒构建 | 8~12天 | 8~12天 |
质粒重组 | 5~10天 | 5~10天 | 慢病毒包装 | 5~10天 | 5~10天 |
腺病毒包装 | 12~15天 | 12~15天 | 病毒浓缩(可选) | 1~2天 | 1~2天 |
大量扩增 | 12~15天 | 12~15天 | 滴度测定 | 3~5天 | 3~5天 |
纯化(可选) | 14~21天 | 14~21天 | 目的细胞感染,筛选 | 14天 | 14天 |
滴度测定 | 3~5天 | 3~5天 | 过表达/干扰效率验证 | 3天 | 3天 |
时间总计 | 52~83天 | 51~82天 | 时间总计 | 37~49天 | 36~48天 |
附5:动物实验对腺病毒和慢病毒的要求及实现方式
| 腺病毒 | 慢病毒 |
是否需要纯化及方法 | 需要纯化,纯化方法:CsCl梯度离心 | 不需要纯化 |
是否需要浓缩及浓缩方法 | 纯化之前需要浓缩,PEG8000沉降法 | 需要浓缩,浓缩方法:超速离心法或PEG8000沉淀法。 |
实现方式 | 注射 | 注射 |
附6:腺病毒的大量制备与CsCl梯度离心纯化病毒
将293细胞铺于30-40个10cm dish,待细胞长满,向每块板中加入合适滴度的病毒(约107-108pfu/ml)10ul,待细胞完全病变后(4-7天),向每块板中加入约500ul 10%的NP-40以裂解细胞,冻存于-80℃。
提前1天将病毒从-80℃冰箱中拿出,室温(或4℃)融解。收集整个细胞裂解物,12000rpm离心10min,弃细胞碎片,收集上清。每100ml上清加入50ml PEG8000(20%PEG8000,2.5M NaCl),冰上放置1小时沉淀病毒(可适当延长)。12000rpm离心上述混合物20min,弃上清,将沉淀物悬浮在10ml密度为1.10g/ml的CsCl溶液中(溶剂为20mM Tris-HCl,PH8.0),毒液应呈粉红色。
CsCl梯度的制备方法如下:加入2.0ml密度为1.40g/ml的CsCl溶液(溶剂同上),然后缓慢加入3.0ml密度为1.30g/ml的CsCl溶液,再加入5ml的病毒悬浮液。20000rpm,室温离心2小时。
收集密度在1.30g/ml和1.40g/ml之间的病毒条带至透析袋中(透析袋使用前用10mM的EDTA-Na2煮沸10min)。在透析缓冲液(50g蔗糖,10ml 1M Tris-HCl,PH8.0,2ml 1M MgCl2定容至1L)中,4℃搅拌透析过夜,中间换一次透析液。收集病毒,测定病毒滴度。
3种浓度的CsCl溶液的配制
密度(g/ml)(20℃) | 浓度(mg/ml) | CsCl的量(g) | 终体积(ml) |
1.40 | 548.3 | 5.483 | 10 |
1.30 | 402.4 | 4.024 | 10 |
1.10 | 143.8 | 1.438 | 10 |
空斑形成单位(PFU)的测定:293细胞铺于60mm dish,24h后细胞接近长满,加入不同稀释度的病毒,37℃感染2小时后,铺8ml低熔点胶(5%FBS,1.25%Agarose)。9天左右计数。上述操作中在最低浓度的培养皿中挑取病毒空斑,可以用来纯化病毒。
病毒颗粒(OPU)的测定:将CsCl离心纯化得到的病毒以适当倍数稀释(OD值在0.1-1.0),测OD260的值,估算病毒颗粒数(OPU):OPU/ml=OD260×稀释倍数×1.1×1012。由于此种方法测出的是病毒的物理浓度,而并没有考虑其生物学活性,即没有活力的病毒也计算在内,因此经验上估算PFU/ml=OPU/100。
附7:腺病毒收到后的注意事项
1、腺病毒的储存
1.1、腺病毒采用冰袋运输。
a、收到病毒液后如未融化请置于-80℃冰箱,下次使用时再进行分装;
b、如客户收到时腺病毒已融化,请直接分装后置于-80℃冰箱保存;若短期内用于实验,可分装部分于4℃保存(尽量一周内用完)。
1.2、尽量避免反复冻融,否则会降低病毒滴度(每次冻融会降低病毒滴度10%)。建议不要在-20℃下长期保存。如果病毒储存时间超过6个月,应该重新测定病毒滴度。
2、腺病毒的稀释
需要稀释病毒时,将病毒取出后置于冰上融解,使用培养目的细胞用PBS或培养基稀释到所需浓度后混匀分装后4℃保存,并尽快用于实验(尽量一周内用完),动物实验建议使用注射用平衡液来稀释,并尽快用完。
- 浏览 27455 次








