LipoFiterTM转染试剂操作说明
|
产品编号 |
产品名称 |
规格 |
|
HB-TRLF-50 |
LipoFiterTM脂质体转染试剂 |
50 μl |
|
HB-TRLF-1000 |
LipoFiterTM脂质体转染试剂 |
1 ml |
保存条件:4℃保存,一年有效(避免反复冻融)。
LipoFiterTM简介
LipoFiterTM脂质体转染试剂( LipoFiterTM Liposomal Transfection Reagent )是一种适合于把质粒或其它形式的核酸,以及核酸蛋白复合物转染到培养的真核细胞中的高效阳离子脂质体转染试剂。
LipoFiterTM优点
1、转染效率高,重复性好,操作简单。
2、无明显细胞毒性,用LipoFiterTM转染细胞后,大多数细胞72小时内不更换培养液无明显细胞毒性。
3、LipoFiterTM对于贴壁细胞和悬浮细胞都适用,并且可以用于稳定表达细胞株的筛选。
LipoFiterTM使用说明
1. 细胞培养:以293T细胞为例,转染前一天(20-24小时) ~0.4×106 细胞(具体的细胞数量据细胞大小和细胞生长速度而定)铺到六孔板内,使第二天细胞汇合度(confluent)能达到约50%~70%。
注1:汉恒生物LipoFiterTM对细胞毒性极小,因此无需通过增大细胞汇合度来抵抗转染试剂毒性,我们实验证明,50%~70% confluent时细胞的转染效率可以达到最优。
注2:其它培养板或培养皿参考六孔板进行操作,详细细胞接种数目请按照比例自行换算。
2. 在进行下述转染步骤前,把六孔板每孔内换成新鲜细胞培养液。培养液的体积约为2 ml。
注:其他培养介质培养液体积参见《各种培养介质下LipoFiterTM转染DNA详表》,抗生素、Glutamine等对LipoFiterTM转染并无影响。如果LipoFiter对目的细胞毒性较大,建议去除转染体系内的抗生素。
3. 把LipoFiterTM脂质体转染试剂轻轻混匀。
4.对于待转染的六孔板中一个孔的细胞,取一只洁净无菌离心管,加入4 μg质粒DNA(其他培养介质DNA用量参见附表)到250 μl DMEM溶液,用枪轻轻吹打混匀。
注:如后续实验需要,可将DMEM用其他如1640、MEM、F12等培养基代替,对LipoFiterTM转染效率及操作并无影响。
5. 取另一只洁净无菌离心管,加入250 µl DMEM溶液,再加入10 μl LipoFiterTM(其他培养介质LipoFiterTM用量参见附表),用枪轻轻吹打混匀,室温放置5分钟。
6. 将步骤4与5中的DNA溶液与LipoFiterTM溶液混合,用枪轻轻吹打混匀。注意:不可Vortex或离心。
7. 室温孵育20分钟。有可能出现絮状沉淀物,属正常现象,不会影响转染效率。
8. 无论是贴壁细胞还是悬浮细胞,均把500 μl LipoFiterTM-DNA混合物全部加入六孔板的一个孔内。加入时注意尽量均匀加入到整个孔内,随后轻轻“8”字摇摆混匀。
注:针对贴壁细胞,如上述所说,只需将LipoFiterTM-DNA复合物加入细胞中孵育6小时再换液即可。若是转染悬浮或半悬浮细胞,则推荐通过平角离心转染法,即将适量的LipoFiterTM-DNA复合物加入细胞培养皿后(步骤8),封口膜封好,放入平角离心机,低速(200 g)离心1.5 小时,然后放入培养箱中正常培养6小时再换液即可。
9. 细胞培养箱内培养6-12小时后,去除含有LipoFiterTM-DNA的无血清培养液。每孔加入2 ml新鲜含血清的细胞培养液继续培养。
注:通常LipoFiterTM-DNA混合物和细胞一起孵育6小时已经足够产生较高的转染效率。大多数细胞和LipoFiterTM-DNA一起培养长达72小时未见明显细胞毒性。但转染后6小时更换新鲜培养液对于一些生长非常快速的细胞有助于提高转染效率。对一些比较易于转染的细胞如HEK-293T细胞,换液可视细胞生长状况而定,无需为提高转染效率而换液。
10. 转染后续处理:
1) 对于基因表达,再培养24-40小时后即可检测转染效果,如转染带GFP或者其他荧光基因的表达载体,可用荧光显微镜观测细胞转染效率。
2) 用于筛选稳定表达细胞株,则在转染后24小时即可加入适当的筛选药物,例如G418或Puromycin(嘌呤霉素)等,进行稳定表达细胞株的筛选。
注1:为了保证实验操作的平行性和稳定性,以6孔板中一个孔为例,目的质粒的量可以在0~4 mg的范围内进行适当调节,只需用空载质粒补平到4 mg即可。而LipoFiterTM的用量通常是4-10 ml(质粒量/LipoFiter量=1:1~1:2.5)。因细胞类型及培养条件、转染参数等会极大的影响转染效率,因此,为了获得最佳转染条件,我们建议在上述参数推荐范围内自行优化。对于多个孔转染相同数量相同质粒的情况可以把每个孔所需的LipoFiterTM和DNA混合物配置在一个离心管内,后续混匀孵育等步骤后可以分加到各个孔内。
注2:对于其它培养板或培养器皿,各种试剂的用量可以参考附录《各种培养介质下LipoFiterTM转染DNA详表》进行换算。
附录
各种培养介质下LipoFiterTM转染DNA详表
|
类型 |
表面积 |
对应细胞培养液体积 |
溶剂DMEM |
DNA |
LipoFiterTM |
|
/cm2 |
对应体积/µl |
||||
|
96-well |
0.3 cm2 |
100 µl |
2 ´ 25 µl |
0.2 µg |
0.2-0.5 µl |
|
48-well |
0.8 cm2 |
350 µl |
2 ´ 37.5 µl |
0.5 µg |
0.5-1.25 µl |
|
24-well |
2 cm2 |
500 µl |
2 ´ 50 µl |
0.8 µg |
0.8-2 µl |
|
12-well |
4 cm2 |
1 ml |
2 ´ 100 µl |
1.6 µg |
1.6-4 µl |
|
6-well |
10 cm2 |
2 ml |
2 ´ 250 µl |
4.0 µg |
4-10 µl |
|
60 mm |
20 cm2 |
4 ml |
2 ´ 0.5 ml |
8.0 µg |
8-20 µl |
|
100 mm |
60 cm2 |
12 ml |
2 ´ 1 ml |
24 µg |
24-60 µl |
转染效果
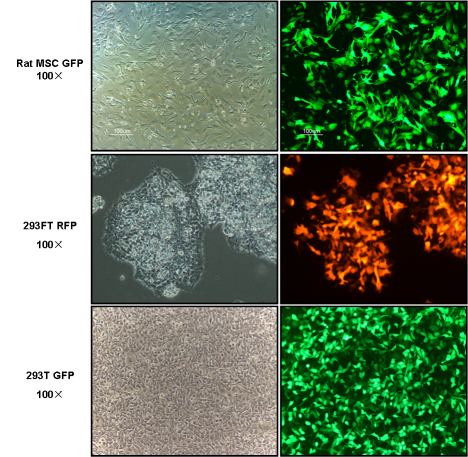
注意事项
1. 使用高纯度的DNA(A260/A280比值越近1.8越好)有助于获得较高的转染效率。对于质粒,推荐使用Qiagen公司生产的质粒大量抽提试剂盒进行高质量无内毒素抽提。
2. 细胞状态会极大影响转染效率,所以转染前细胞必须处于良好的生长状态。
3. 需自备DMEM培养基,其他培养基如1640、MEM、alpha-MEM,F12,DMEM/F12、M199也均可以用于转染实验。
4. LipoFiterTM不能vortex或离心,宜缓慢晃动混匀。
5. LipoFiterTM使用后请立即盖好盖子,避免长时间暴露在空气中,影响转染效率。
6. 经测试,LipoFiterTM细胞毒性不明显,非常适用于病毒包装(慢病毒,腺病毒,腺相关病毒,逆转录病毒等);请在进行病毒包装时严格按照病毒安全操作进行。
7. 为了您的安全和健康,请在符合洁净度要求的细胞培养室中进行转染操作,操作时请穿实验服并戴一次性手套、口罩和无菌帽。
- 浏览 26103 次








